
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эффект Доннана. Мембранное равновесие Доннана
|
|
|
|
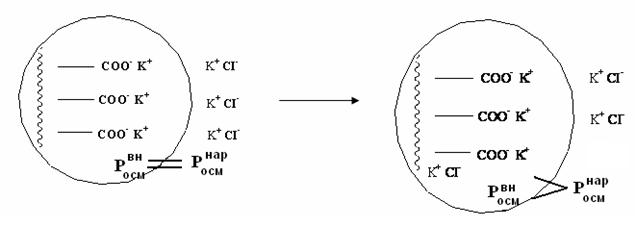
Эффект Доннана наблюдается в системах, содержащих полупроницаемую мембрану, которая разделяет два раствора электролитов. Причем, по одну сторону мембраны находятся ионы низкомолекулярного электролита, а по другую – высокомолекулярный электролит, чьи ионы не могут переходить через мембрану: RCOO– Na+, RNH3+ Cl–.
Суть этого эффекта состоит в том, что всегда ионы низкомолекулярного электролита переходят через мембрану в сторону ионов высокомолекулярного электролита до тех пор, пока не установится мембранное равновесие Доннана – равенство произведения концентраций подвижных низкмолекулярных ионов по обе стороны мембраны:
[Kt+]вн ∙ [An–]вн = [Kt+]нар ∙ [An–]нар (5.3)
Примером таких систем в живой природе, где наблюдается эффект Доннана, является клетка. В клетке всегда имеются соли белков PtCOO–Na+ с белковым анионом, не проходящим через клеточную мембрану. Снаружи клетки имеется раствор низкомолекулярного сильного электролита.
|

а. исходное состояние б. равновесное состояние
Рис.5.7 Мембранное равновесие Доннана
Рассмотрим случай, когда общее число ионов в клетке и снаружи одинаково. Тогда наружный и внутренний растворы должны быть изотоничны.
Росмвн = Росмнар
Но растворы неравновесны с точки зрения диффузии, поэтому низкомолекулярные ионы CI- будут диффундировать внутрь клетки, т.к. их там нет. А за ними перейдет внутрь клетки столько же катионов K+, чтобоы сохранить электронейтральность системы. Этот переход будет происходить до тех пор, пока произведение концентрации подвижных низкомолекулярных ионов по обе стороны мембраны не выровняется.
[K+]вн · [CI-]вн = [K+]нар · [CI-]нар
Переход части подвижных ионов внутрь клетки приводит к повышению осмотического давления в клетке, раствор в ней становится гипертоническим. Это приводит к осмосу воды в клетку, что и обуславливает тургор клетки (т.е её упругость). Из-за эффекта Доннана общая концентрация ионов в клетке выше, чем снаружи, возникает мембранный потенциал.
Число подвижных ионов, перешедших в клетку, рассчитывается по уравнению 5.4
|
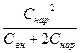
Сколько ионов переходит в клетку, зависит от исходного соотношения концентрации ионов по обе стороны мембраны:
а) если наружный раствор является гипертоническим, Свн <<Снар, то Х = Сн2/2Сн = Сн/2, то в клетку перейдет половина наружных низкомолекулярных ионов.
б) Если растворы изотоничны, Свн = Снар, то Х = Сн2/Сн + 2Сн = Сн/3. Даже при равной концентрации ионов электролита 1/3 низкомолекулярных ионов перейдет в клетку.
в) Если Свн >> Снар, то Х – очень малая величина, но всегда Х>0.
Следовательно, при соприкосновении клетки с раствором низкомолекулярного электролита всегда часть его ионов переходит в клетку, поэтому осмотическое давление в клетке будет выше (Р белка + Рэл-та), что способствует поддержанию тургора клеток даже изотонических растворов.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 8593; Нарушение авторских прав?; Мы поможем в написании вашей работы!