
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Удельная электрическая проводимость растворов электролитов
Электрическая проводимость растворов электролитов. Кондуктометрия
Электрическая проводимость (электропроводность) – это способность вещества проводить электрический ток.
Она является величиной обратной электрическому сопротивлению. По способности вещества проводить ток все проводники разделяют на два типа:
Проводники первого рода – металлы, в них электропроводность обусловлена направленным движением свободных электронов.
Проводники второго рода – это растворы электролитов. В них электропроводность возникает при наложении внешнего поля за счет направленного движения катионов к отрицательно заряженному электроду, катоду, а анионов к положительному электроду, аноду. В отсутствии внешнего поля ионы движутся хаотично и тока нет.
Способность раствора электролита проводить ток определяется главным образом
- количеством ионов
- подвижностью ионов.
Подвижность ионов, т.е. скорость их направленного движения к электродам, способность преодолевать сопротивление среды, зависит от:
1. природы растворителя. Чем выше его полярность и вязкость, тем меньше в нем подвижность ионов. Полярные растворители сильнее сольватируют ионы, делая их крупнее и менее подвижными.
2. природы иона. Чем меньше радиус иона и больше его заряд, тем больше ион сольватирован и менее подвижен. Поэтому подвижность гидратированных ионов 1 группы возрастает от Li к Cs.
Самой высокой подвижностью обладают протоны и гидроксид-ионы (Н+ и ОН–) в водных растворах. Но это объясняют особым «эстафетным» механизмом их перемещения.
3. температуры. С повышением температуры уменьшается вязкость среды и толщина сольватных оболочек, а значит возрастает подвижность ионов.
4. ионной силы. Чем сильнее межионное взаимодействие, тем сильнее тормозящий эффект.
5. концентрации ионов. Чем она выше, тем выше электростатическое взаимодействие ионов, снижающее их подвижность.
Концентрация ионов зависит и от силы электролитов. В растворах слабых электролитов (α < 0,03) концентрация ионов всегда невелика. При бесконечном разбавлении скорости движения ионов возрастают и достигают предельного значения. Их называют предельной электрической подвижностью ионов в данном растворителе и температуре.
Электрическая проводимость (электропроводность) обратна сопротивлению: L = 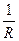 ;
; 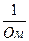 = См (6.1)
= См (6.1)
Единицей измерения в системе СИ является обратный Ом (Ом–1) или сименс, См.
Известно, что сопротивление любого проводника пропорционально его длине и обратно пропорционально сечению, S:
R = ρ • 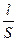 (6.2)
(6.2)
где ρ – удельное сопротивление, Ом•м, характеризующее природу проводника.
Подставляя уравнение (6.2) в уравнение в уравнение (6.1), получаем:
L = 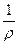 •
• 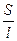 = æ •
= æ • 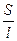
 (6.3)
(6.3)
где æ (каппа) – удельная электрическая проводимость, См/м, величина обратная удельному сопротивлению. Она характеризует свойства проводящей среды – раствора электролита.
Удельная электрическая проводимость представляет собой проводимость 1м3 раствора помещенного между параллельными электродами площадью 1м2, находящимися на расстоянии 1м.
В системе СИ единица измерения удельной электрической проводимости: См/м. В аналитической практике æ часто выражается в См/см.
1См/см = 102 См/м.
Удельная электропроводность максимальна у растворов сильных кислот и оснований из-за их полной диссоциации и высокой подвижности ионов Н+ и ОН–. Наименьшей удельной электропроводностью обладают растворы слабых электролитов из-за низкой концентрации ионов. Удельная электропроводность зависит от концентрации электролита. С повышением концентрации она проходит через максимум, а затем уменьшается. Это связано, для сильных электролитов, с возрастанием мешающего межионного взаимодействия, а для слабых – со снижением степени диссоциации.
Молярная (эквивалентная) электрическая проводимость растворов электролитов.
Молярная электрическая проводимость раствора электролита (λ, лямбда) равна удельной электрической проводимости его раствора с концентрацией 1 моль/м3.
λ = 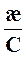 (6.4)
(6.4)
где æ – удельная электропроводность, См/м,
С – концентрация раствора электролита, моль/м3.
В системе СИ λ выражается в См • м2/моль.
λ = 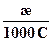 , См∙м2/моль (6.5)
, См∙м2/моль (6.5)
Поскольку в аналитической практике молярная концентрация выражается в моль/л (1моль/л = 103моль/м3), то для расчетов чаще используют формулу (6.6)
λ = 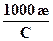 См∙см2/моль (6.6)
См∙см2/моль (6.6)
Влияние концентрации на молярную проводимость электролитов лучше проследить на графике зависимости λ от разбавления (1/С):
|
|
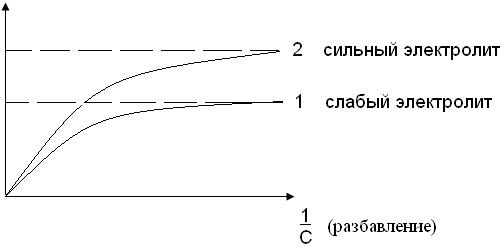
Рис.6.1. Зависимость молярной электрической проводимости от
|
|
Дата добавления: 2014-11-20; Просмотров: 3561; Нарушение авторских прав?; Мы поможем в написании вашей работы!