
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анодные процессы
|
|
|
|
На аноде возможны процессы окисления:
· материала анода Ме - nē = Me n+
· молекул воды 2H2O - 4 ē =О 2+ 4H +
· анионов солей
2Cl — - 2 ē = Cl2 NO2— - 2 ē + H2O = NO3— + 2H +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2—, NO3— и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:
K2SO4 = 2K + + SO42—
 (-) Kатод K+ H2O(+) Aнод SO4 2— H2O
(-) Kатод K+ H2O(+) Aнод SO4 2— H2O
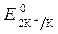 = - 2,92 B;
= - 2,92 B;  = -1 B. Сульфат-ионы не разряжаются.
= -1 B. Сульфат-ионы не разряжаются.
Так как 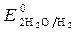 >
> 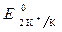 ,
, 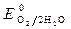 » 1,8 B.
» 1,8 B.
происходит восстановление воды: 2H2O - 4 ē = O2 + 4 H +
2H2O +2 ē = H 2+ 2 OH —
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —
 (-) Kатод Sn 2 +, H2O(+) Aнод Cl —, H2O
(-) Kатод Sn 2 +, H2O(+) Aнод Cl —, H2O
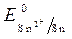 = - 0,136 B;
= - 0,136 B; 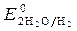 = -1B.
= -1B. 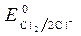 = 1,36 В;
= 1,36 В; 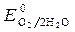 » 1,8 B.
» 1,8 B.
Так как 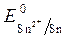 >
> 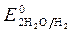 , Так как
, Так как 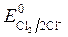 <
< 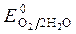 , идет идет процесс восстановления процесс окисления ионов Сl -:
, идет идет процесс восстановления процесс окисления ионов Сl -:
ионов олова: Sn2+ + 2 ē = S n 2Cl — - 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:
CuSO4 =Cu2+ + SO42-
 (-) Kатод Cu 2+ H2O (+) Aнод - Сu SO4 2— H2O
(-) Kатод Cu 2+ H2O (+) Aнод - Сu SO4 2— H2O
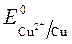 = + 0,34 B;
= + 0,34 B; 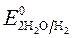 = -1 B.
= -1 B. 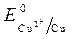 = + 0,34 B;
= + 0,34 B; 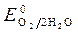 » 1,8 B.
» 1,8 B.
Так как 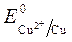 >
> 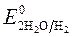 , Сульфат-ионы не разряжаются.
, Сульфат-ионы не разряжаются.
происходит восстановление Так как  <
< 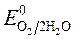 ,
,
ионов меди: Cu 2+ +2ē = Cu анод растворяется: Cu - 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
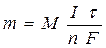 ,
,
где m - масса образовавшегося вещества, г;
М - молярная масса вещества, г/ моль;
n - количество электронов, участвующих в электродном процессе;
I - сила тока, А;
t - время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 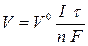 ,
,
где V - объем газа, выделяющегося на электроде; V 0 - объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 860; Нарушение авторских прав?; Мы поможем в написании вашей работы!