
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическая коррозия металлов
|
|
|
|
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
· молекулы кислорода
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
Ме1 / среда / Ме2.
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1. Гальванопара алюминий - железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 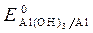 = - 1,88 B;
= - 1,88 B; 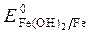 = - 0,46B;
= - 0,46B;
 = + 0,814B.
= + 0,814B.
Восстановитель – Al, окислитель - О2.
 · Al(-): 4 Al - 3 ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
· Al(-): 4 Al - 3 ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
 Fe(+): 3 О2 + 4 ēē + 2Н2 О = 4ОН — - процесс восстановления
Fe(+): 3 О2 + 4 ēē + 2Н2 О = 4ОН — - процесс восстановления
4Al + 3О 2 + 6Н2О = 4Al(OH)3
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
ē

 (-) Al/ Fе (+) ē
(-) Al/ Fе (+) ē
 О2, Н2О
О2, Н2О
Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н+), если нарушена сплошность покрытия.
· Схема гальванопары:
Fe / Н2 О, О2, Н+ / Sn
· Потенциалы:  = - 0,44 B;
= - 0,44 B; 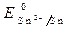 = - 0,136 B;
= - 0,136 B;
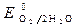 = + 1,228 B.
= + 1,228 B.
Восстановитель – железо, окислитель – кислород.
 ·Fe(-): 2 Fe - 2 ē = Fe 2+ – процесс окисления
·Fe(-): 2 Fe - 2 ē = Fe 2+ – процесс окисления
 Sn(+): 1 О2 + 4 ē + 4Н+ =2Н2О – процесс восстановления
Sn(+): 1 О2 + 4 ē + 4Н+ =2Н2О – процесс восстановления
2Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4НCl = 2FeCl2 + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:
·
ē
 (-) Fe/ Sn (+) ē
(-) Fe/ Sn (+) ē
 О2, Н+
О2, Н+
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы:  = - 2,36 B;
= - 2,36 B; 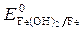 = - 0,874 B;
= - 0,874 B;
 = - 0,827 B. Восстановитель - алюминий, окислитель - вода.
= - 0,827 B. Восстановитель - алюминий, окислитель - вода.
·  Al(-): 2 Al - 3 ē + 4OH — = AlO2— + 2H2O – процесс окисления
Al(-): 2 Al - 3 ē + 4OH — = AlO2— + 2H2O – процесс окисления
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления 
2 Al + 2 OH — + 2H2O = 2 AlO2— + 3 H2
2 Al + 2 КOH + 2H2O = 2КAlO2 + 3 H2
Разрушается алюминий.
· Направление перемещения электронов в системе:
ē

 (-) Al/ Fe (+) ē
(-) Al/ Fe (+) ē
 H2O, KOH
H2O, KOH
Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н+ | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 8798; Нарушение авторских прав?; Мы поможем в написании вашей работы!