
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды
|
|
|
|
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз является обратимым процессом. В реакциях гидролиза участву-
ют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O 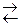 H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
H+ + OH— ; в результате среда становится либо кислой (рН < 7), либо щелочной (pH > 7).
· Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (pH > 7). Первая ступень гидролиза: Na2CO3 + HOH 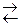 NaHCO3 + NaOH; CO32— + HOH
NaHCO3 + NaOH; CO32— + HOH 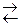 HCO3– + OH—
HCO3– + OH—
· Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (pH < 7).
Первая ступень гидролиза:
Cu(NO3)2 + HOH 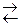 CuOHNO3 + HNO3 Cu2+ + HOH
CuOHNO3 + HNO3 Cu2+ + HOH 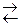 CuOH+ + H+
CuOH+ + H+
· Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
CH3COONH4 + HOH 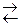 CH3COOH + NH4OH
CH3COOH + NH4OH
CH3COO— + NH4+ + HOH 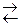 CH3COOH + NH4OH
CH3COOH + NH4OH
· При совместном гидролизе двух солей образуются слабое основание и слабая кислота: 2FeCl3 + 3Na2S +6H2O = 2Fe(OH)3 ¯ + 3H2S + 6NaCl
2Fe3+ + 2S2— + 6H2O = 2Fe(OH)3 ¯ + 3H2S
· Соль, образованная сильной кислотой и сильным основанием, гидролизу
не подвергается, реакция среды нейтральная: KNO3 + HOH ¹
Ионы K+ и NO3— не образуют с водой слабодиссоциирующих продуктов (KOH и HNO3 – сильные электролиты).
Задания к подразделу 3.3
Задания 201-220. Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи).
| 201.NaNO2, Cu(NO3)2 | 211.Na2HPO4, Mg(NO3)2 |
| 202.AlCl3, NaHCO3 | 212.Al2 (SO4)3, Na2SeO3 |
| 203.Na3PO4, ZnCl2 | 213.CuSO4, K3PO4 |
| 204.FeCl2, K2S | 214.Na2SO3, Fe2 (SO4)3 |
| 205.K2SO3, ZnSO4 | 215.NaCN, FeSO4 |
| 206.NH4Cl, KClO | 216.Ba(CH3COO)2, CoSO4 |
| 207.Na2Se, MnCl2 | 217.NiSO4, NaF |
| 208.ZnSO4, BaS | 218.Pb(NO3)2, Ba(NO2)2 |
| 209.Ni (NO3)2, KNO2 | 219.Cr2(SO4)3, Na CH3COO |
| 210.NH4Br, Na2S | 220.KHS, MgSO4 |
Задания 221-240. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей.
| 221.Fe2(SO4)3 + Na2CO3 | 231.CrCl3 + K2S |
| 222.Na2S + Al2 (SO4)3 | 232.Na2CO3 + Cr (NO3)3 |
| 223.NH4Cl + Na2SiO3 | 233.K2SiO3 + Bi (NO3)3 |
| 224.Cr2 (SO4)3 + K2S. | 234.Na2SO3 + CrCl3 |
| 225.K2CO3 + Bi (NO3)3 | 235.NH4NO3 + Na2SiO3 |
| 226.Na2S + AlCl3 | 236.AlCl3 + Na2SO3 |
| 227.BeSO4 + K2S | 237.K2SO3 + CrCl3 |
| 228.Cr2 (SO4)3 + Na2SO3 | 238.Na2S + Al2 (SO4)3 |
| 229.K2SO3 + AlBr3 | 239.Fe (NO3)3 + K2CO3 |
| 230.Bi (NO3)3 + Na2CO3 | 240.Al2 (SO4)3 + Na2CO3 |
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1230; Нарушение авторских прав?; Мы поможем в написании вашей работы!