
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типичных задач
|
|
|
|
Пример 1. Задача на разбавление.
Какой объем 95%-ного раствора серной кислоты (r =1,84 г/мл) надо взять для приготовления 400г 10%-ного раствора кислоты?
Приготовление раствора означает, что концентрированный раствор разбавляют водой. При этом остается неизменной масса растворенного вещества.
Кратко запишем условия задачи, обозначив параметры исходного раствора с индексом 1, приготовляемого раствора с индексом 2.
 Дано: Решение:
Дано: Решение:
С% 1=95% · Из выражения для процентной концентрации r1 =1,84 г/мл приготовляемого раствора выразим необходимую
m 2 Р-РА=400 г массу растворенного вещества (серной кислоты):
 C% 2=10%
C% 2=10% 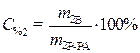
 (1)
(1)
Найти: V 1=? · Определяем массу серной кислоты (m 1В) в исходном
растворе:  так как m 1Р-РА = V 1 ·ρ 1, то
так как m 1Р-РА = V 1 ·ρ 1, то

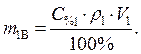 (2)
(2)
· Поскольку m 1В= m 2В, то приравниваем выражения (1) и (2).


· Расчет 
Ответ: объем 95%-ного раствора серной кислоты равен 22,9 мл.
Пример 2. Задача с расчетом по уравнению химической реакции.
Какая масса 25%-ного раствора гидроксида калия расходуется на нейтрализацию 75 г 15%-ного раствора уксусной кислоты?
Обозначим параметры, относящиеся к уксусной кислоте, индексом 1, гидроксиду калия – индексом 2.
 Дано: Решение:
Дано: Решение:
C% 1= 15% · Уравнение реакции нейтрализации:
m 1 Р-РА=75 г СH3COOH + KOH = CH3 COOK + H2O
C% 2= 25% · Рассчитаем массу растворенного вещества,
содержащегося в растворе уксусной кислоты: 
Найти: m 2Р-РА=?


· Определяем количество вещества (уксусной кислоты), содержащееся в растворе:

· По уравнению реакции 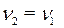 . Рассчитаем
. Рассчитаем 

· Найдем массу растворенного вещества, содержащегося в растворе гидроксида калия: 
· Определяем массу раствора гидроксида калия, содержащего данное количество растворенного вещества – гидроксида калия:

Ответ: 42 г – масса раствора гидроксида калия, которая расходуется на реакцию с уксусной кислотой.
Пример 3. Задача на приготовление раствора соли из кристаллогидрата
В 450 г воды растворили 50 г CuSO4×5H2O. Вычислить процентное содержание кристаллогидрата (CuSO4×5H2O) и безводной соли (CuSO4) в растворе.
Обозначим параметры раствора кристаллогидрата с индексом 1, раствора безводной соли с индексом 2.
 Дано: Решение:
Дано: Решение:
 =450г · Найдем общую массу раствора:
=450г · Найдем общую массу раствора:
 m 1В = 50г m Р-РА = m 1Р-РА = m 2Р-РА =
m 1В = 50г m Р-РА = m 1Р-РА = m 2Р-РА = 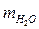 + m 1В.
+ m 1В.
Найти: mР-РА = 450г + 50г = 500 г.
С% 1, С% 2 =?
· Рассчитаем процентное содержание кристаллогидрата в растворе:

· Определим массу безводной соли в растворе:




· Процентное содержание безводной соли в растворе:

Ответ: 10% – содержание кристаллогидрата в растворе, 6,39% – содержание безводной соли в растворе.
Пример 4. Задача на расчет молярной концентрации, если известна процентная концентрация.
Определить молярную концентрацию 36,2% - го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
 Дано: Решение:
Дано: Решение:
С% = 36,2 % · Из выражения для процентной концентрации
r = 1,18г/мл данного раствора выразим необходимую массу
 растворенного вещества (соляной кислоты):
растворенного вещества (соляной кислоты):
Найти: СМ =? 
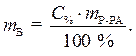 (1)
(1)
· Подставляем массу соляной кислоты (mВ) в формулу, выражающую молярную концентрацию раствора и, учитывая, что mР-РА = V · ρ, записываем формулу перехода от процентной концентрации к молярной:
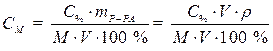 . (2)
. (2)
· Для приведения размерности применяемых величин в соответствие выразим плотность раствора в г/л r =1,18·103г/л, тогда объем раствора получится в литрах и сокращается, формула приобретает следующий вид:
 . (3)
. (3)
· Производим расчет, используя формулу (3) для перехода от процентной концентрации к молярной:

Ответ: 11,7моль/л.
Пример 5. Задача на определение процентной концентрации, если известна молярная концентрация раствора.
Определить процентное содержание растворенного вещества в 1,68 М растворе H2SO4, плотность которого равна 1,1 г/мл.
 Дано: Решение:
Дано: Решение:
СМ = 1,68 моль/л · Расчет произведем, используя формулу из табл.3.2
r = 1,1г/мл для перехода от молярной концентрации к процентной
 (вывод формулы можно произвести самостоятельно,
(вывод формулы можно произвести самостоятельно,
Найти: С% =?используя пример 4):
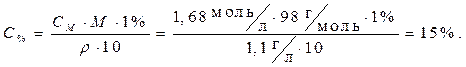
Ответ: 15 %.
Задания к подразделу 3.1
Каждое задание содержит по две задачи (а,б).
101. а) К 500 мл раствора соляной кислоты (ρ = 1,10 г/мл) прибавили 2,5 л воды, после чего раствор стал 4%-ным. Определите процентное содержание растворенного вещества в исходном растворе. б) Определите молярную концентрацию 10%-ного раствора азотной кислоты (ρ = 1,06 г/мл).
102. а) Определите молярную концентрацию раствора сульфата калия, в 200 мл которого содержится 1,74 г растворенного вещества. б) Определите процентное содержание растворенного вещества 1 М раствора нитрaта никеля(II), плотность которого 1,08 г/мл.
103. а) Определите молярную концентрацию 10%-ного раствора серной кислоты (ρ = 1,07 г/мл). б) Сколько мл воды следует прибавить к 100 мл
20%-ного раствора серной кислоты (ρ = 1,14 г/мл) для получения 5%-ного раствора?
104. а) В каком объеме воды следует растворить 32,2 г Na2SO4 × 10H2O, чтобы получить 5%-ный раствор сульфата натрия? б) Определите процентное содержание растворенного вещества 0,9 М раствора H3PO4 (ρ = 1,05 г/мл).
105. а) Сколько граммов медного купороса СuSO4 × 5H2O и воды требуется для приготовления 150 г 8%-ного раствора в расчете на безводную соль?
б) Определите молярную концентрацию 27%-ного раствора соляной кислоты
(ρ = 1,14 г/мл).
106. а) До какого объема следует разбавить 1,5 л 20%-ного раствора хлорида аммония (ρ = 1,06 г/мл), чтобы получить 10%-ный раствор (ρ = 1,03 г/мл)?
б) Сколько миллилитров 70%-ного раствора нитрата калия (ρ = 1,16 г/мл) требуется для приготовления 0,5 л 0,2 М раствора?
107. а) Сколько граммов кристаллической соды Na2CO3 × 10H2O надо взять для приготовления 2 л 0,2 М раствора Na2CO3? б) Cколько миллилитров 36%-ного раствора соляной кислоты (ρ = 1,18 г/мл) требуется для приготовления 4 л 0,5 М раствора?
108. а) К 1 л 20%-ного раствора гидроксида натрия (ρ = 1,22 г/мл) прибавили
10 л воды. Определите процентное содержание растворенного вещества в полученном растворе. б) Определите молярную концентрацию 8%-ного раствора сульфата натрия (ρ = 1,08 г/мл).
109. а) Сколько миллилитров 10%-ного раствора Na2CO3 (ρ = 1,10г/мл) следует прибавить к 1 л 2%-ного раствора (ρ = 1,02 г/мл), чтобы получить 3%-ный раствор этой соли? б) Определите процентное содержание растворенного вещества в 2 М растворе гидроксида натрия (ρ = 1,08 г/мл).
110. а) Сколько миллилитров воды следует прибавить к 25 мл 40%-ного раствора KOH (ρ =1,40 г/мл), чтобы получить 2%-ный раствор? б) Сколько миллилитров 96 % -ного раствора серной кислоты (ρ = 1,84 г/мл) требуется для приготовления 300 мл 0,5 М раствора?
111. а) Сколько граммов медного купороса СuSO4 × 5H2O следует добавить к 150 мл воды, чтобы получить 5%-ный раствор СuSO4? б) Сколько миллилитров 30%-ного раствора азотной кислоты (ρ = 1,84 г/мл) требуется для приготовления 250 мл 0,5 М раствора?
112. а) Определите процентное содержание растворенного вещества в 0,25 М растворе гидроксида натрия (ρ = 1,01 г/мл). б) Сколько миллилитров 0,1 М раствора HCl можно приготовить из 20 мл 0,5 М раствора этой кислоты?
113. а) Определите молярную концентрацию 10%-ного раствора соляной кислоты (ρ = 1,05 г/мл). б) Сколько миллилитров 30%-ной азотной кислоты с ρ = 1,18 г/мл требуется для приготовления 250 мл 11%-ного раствора
(ρ = 1,07 г/мл)?
114. а) Сколько миллилитров 30%-ного раствора KOH (ρ = 1,29 г/мл) требуется для приготовления 300 мл 0,1 М раствора? б) К 760 мл 20%-ного раствора NaOH (ρ = 1,22 г/мл) прибавили 140 мл 10%-ного раствора NaOH (ρ = 1,11 г/мл). Определите процентное содержание растворенного вещества.
115. а) К 50 мл 96%-ного раствора серной кислоты (ρ = 1,84 г/мл) прибавили 50 мл воды. Определите процентное содержание растворенного вещества в полученном растворе. б) Определите молярную концентрацию 72%-ного раствора азотной кислоты (ρ = 1,43 г/мл).
116. а) Определите молярную концентрацию 6%-ного раствора фосфорной кис-лоты (ρ = 1,03 г/мл). б) Определите процентное содержание растворенного вещества раствора, полученного смешением 10 мл 96%-ного раствора азотной кислоты (ρ =1,50г/мл) и 20мл 48%-ного раствора НNO3 (ρ = 1,30 г/мл).
117. а) До какого объема следует разбавить 500 мл 20%-ного раствора хлорида натрия (ρ = 1,15 г/мл), чтобы получить 4,5%-ный раствор (ρ = 1,03 г/мл)?
б) Определите молярную концентрацию 50%-ного раствора азотной кислоты (ρ = 1,31 г/мл).
118. а) Определите молярную концентрацию 60%-ного раствора серной кислоты (ρ = 1,50 г/мл). б) Сколько миллилитров 32%-ного раствора азотной кислоты (ρ = 1,19 г/мл) требуется для приготовления 300 мл 0,75 М раствора?
119. а) Сколько миллилитров 0,2 М раствора азотной кислоты необходимо для нейтрализации 80 мл 0,6 М раствора NaOH? б) Определите процентное содержание растворенного вещества в 1,5 М растворе KOH (ρ = 1,07 г/мл).
120. а) Определите молярную концентрацию 10%-ного раствора карбоната натрия (ρ = 1,10г/мл). б) Сколько миллилитров 30%-ного раствора NH4OH (ρ = 0,90 г/мл) требуется для получения 400 мл 2 М раствора?
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 822; Нарушение авторских прав?; Мы поможем в написании вашей работы!