
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Слабые электролиты
|
|
|
|
Сильные электролиты
Электролитическая диссоциация. Ионно-молекулярные уравнения
Электролитами называют вещества, растворы и расплавы которых про-
водят электрический ток.
К электролитам относятся неорганические кислоты, а также основания, амфотерные гидроксиды и соли. Они распадаются в водных растворах и расплавах на катионы (Кn+) и анионы (Аm-).
Процесс распада молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации (или ионизации).
Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (ионизации) - α, которая равна отношению числа молекул, распавшихся на ионы (n), к общему числу молекул электролита, введенных в раствор (N):
α = n / N.
Такимобразом, α выражаютв долях единицы.
По степени диссоциации электролиты условно подразделяют на сильные (α» 1) и слабые (α <0,3).
· Соли (средние, кислые, основные): А12(SO4)3, NаHCO3, СuОНСl.
· Неорганические кислоты: НNO3, H2SO4, НС1, НВг, НI, НСlО4. и др.
· Гидроксиды щелочных и щелочноземельных металлов: КОН, NаОН, Са(ОН)2, Ва(ОН)2 и др.
Сильные электролиты диссоциируют в водном растворе практически нацело: А12(SO4)3 = 2А13++3 SO42– NаHCO3 = Nа+ +НСО3–
НNО3 = H++NО3– Н2SO4 = 2Н++SО42–
СuОНСl = CuOH++Cl– Ва(ОН)2 = Ва2++2ОН–
· Почти все органические кислоты: CH3COOH, H2C2O4 и др..
· Некоторые неорганические кислоты: H2CO3, H2S, HCN, H2SiO3, HNO2,
H2SO3, H3PO4, HClO и др.
· Гидроксиды металлов основного характера (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH.
· Амфотерные гидроксиды: Al(OH)3, Zn(OH)2, Cr(OH)3, Sn(OH)2, Pb(OH)2 и др.
Для слабых электролитов диссоциация – обратимый процесс, для которого справедливы общие законы равновесия.
Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) К Д (табл.П.3):
CH3COOH 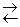 CH3COO– + H+
CH3COO– + H+

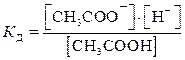
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем К д1 всегда больше К д2 и т.д.), например при диссоциации H2S:1-я ступень H2S 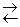 H+ + HS–
H+ + HS– 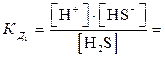 6ּ10-8;
6ּ10-8;
2-я ступень HS– 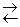 H+ + S2-
H+ + S2- 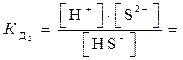 1·10-14,
1·10-14,
где [ ] ─ равновесные концентрации ионов и молекул.
Диссоциация Сu(OH)2:
1-я ступень Сu(OH)2 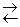 Cu(OH)+ + OH –
Cu(OH)+ + OH –
2-я ступень Cu(OH)+ 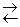 Cu2+ + OH –
Cu2+ + OH –
Амфотерные гидроксиды, напримерPb(OH)2,диссоциируют по основному типу: Pb(OH)2 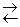 PbOH+ + OH –
PbOH+ + OH –
PbOH+ 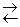 Pb2+ + OH–
Pb2+ + OH–
и кислотному: H2PbO2 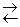 H+ + HPbO2–
H+ + HPbO2–
HPbO2– 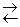 H+ + PbO22 –
H+ + PbO22 –
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакций все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций:
· образование труднорастворимых соединений:
Рb(NО3)2 + 2КI = ¯РbI2 + 2КNО3 Рb2+ +2I – = ¯РbI2
· реакции с участием слабодиссоциирующих соединений:
СН3СООNa + НС1 = СН3COOH + NаС1
СН3COO – + Н+ = СН3COOH
НС1 + NаОН = NаС1 + Н2O Н+ + ОН – = Н2O
НС1 + NН4OН = NН4С1+ H2O Н+ + NH4OH =NH4+ + Н2O
СН3COOH +NН4OН = СН3COONH4 + Н2О
СН3COOH + NН4OН = CН3COO – + NH4+ + Н2O
· образование газообразных веществ:
Nа2СО3 + 2НС1 = 2NаС1 + СО2 + Н2О СО32–+ 2Н+ = СO2+ Н2O
Пример 1. Осуществить превращения NаОН ® NаНSО3 ® Nа2SO3.
Решение. NаОН + Н2SO3 = NаНSO3 + Н2O
ОН– + Н2SO3 = НSО3– +Н2О
NаHSO3 +NаОН = Nа2SO3 + Н2O
НSО3– + ОН – = SO32 – + Н2О
Пример 2. Осуществить превращения Ni(ОН)2 ® (NiOH)2SO4 ® NiSO4.
Решение. 2Ni(ОH)2 + Н2SO4 = (NiOН)2SO4 + Н2O
¯2Ni(ОН)2 + 2Н+ + SO42 – = ¯(NiОН)2SO4 + Н2O
¯(NiОН)2SO4 + Н2SO4 = 2NiSO4 + 2Н2О
¯(NiOН)2SO4 + 2Н+ = 2Ni 2+ + 2SO42– + 2Н2О
Внимание! Основные соли, как правило, нерастворимы в воде, поэтому при написании ионных уравнений их не расписывают на ионы.
Задания к подразделу 3.2
Задания 121-140. Напишите в молекулярной и ионной формах уравнения возможных реакций предложенных оксидов с H2O, Na2O, KOH, HNO3.
| 121.N2O3; Na2O | 126.SO2; CuO | 131.MnO; P2O5 | 136.N2O5; CuO |
| 122.SnO; P2O5 | 127.Cr2O3; Cl2O7 | 132.BaO; Mn2O7 | 137.P2O5; CoO |
| 123.SO3; CaO | 128.CoO; ZnO | 133.CdO; SnO | 138.PbO; MgO |
| 124.SiO2; NiO | 129.P2O3; FeO | 134.As2O5; CuO | 139.Cl2O7; MnO |
| 125.PbO; N2O5 | 130.Fe2O3; K2O | 135.Al2O3; SiO2 | 140.SO3; TiO |
Задания 141-160. Напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их с H2SO4 и NaOH.
| 141.HCl; Cr(OH)3 | 151.Ca(OH)2; H3PO4 |
| 142.Cd(OH)2; H2S | 152.HNO3; Be(OH)2 |
| 143.Cu(OH)2; HBr | 153.H2Сr2O7; KOH |
| 144.H2SO3; Sn(OH)2 | 154.HCN; Ga(OH)3 |
| 145.H2SiO3; Pb(OH)2 | 155.KOH; H2CO3 |
| 146.CH3COOH; Fe(OH)3 | 156.HF; Be(OH)2 |
| 147.H2Se; Zn(OH)2 | 157.NH4OH; HClO4 |
| 148.Fe(OH)2; H3AsO3 | 158.Pb(OH)2; HNO2 |
| 149.RbOH; HI | 159.Mg(OH)2; HClO |
| 150.H2Te; Al(OH)3 | 160.Ga(OH)3; HMnO4 |
Задания 161-180. Напишите уравнения диссоциации солей и назовите их.
| 161.ZnCl2, MnOHCl, Ba(HSO3)2 | 171.Pb(HSO4)2, NH4NO3, CoOHCl |
| 162.K2HAsO3, AlOHCl2, Na2SO3 | 172.Al(OH)2NO3, Fe2(SO4)3, KHSe |
| 163.KHSO3, (PbOH)2SO4, CrBr3 | 173.CsHTe, Ca3(PO4)2, MnOHBr |
| 164.Fe(NO3)3, SnOHCl, NaHTe | 174.Mn(NO3)2, Bi(OH)2Cl, KHS |
| 165.NaHSe, CoOHNO3, MgCl2 | 175.Al2(SO4)3, CrOHCl2, KHSO3 |
| 166.CdOHBr, NiCl2, KH2PO4 | 176.NaHSe, NiOHNO3, ZnSO4 |
| 167.CaBr2, (SnOH)2SO4, K2HPO4. | 177.CrOHSO4, BaBr2, CsHSO3 |
| 168.BaCl2, Ca(HCO3)2, AlOHCl2 | 178.Cu(NO3 )2, CoOHCl, NaHS |
| 169.NiBr2, (CoOH)2SO4, KHCO3. | 179.FeCl2, NaH2AsO4, KCrO2 |
| 170.NiOHCl, NiBr2, NaH2PO4 | 180.AlOHBr2, Sr(HS)2, K2SO3 |
Задания 181-200. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений.
181. Ni(OH)2 (NiOH)2SO4 NiSO4 Ni(OH)2; H3PO4 KH2PO4
182. CuSO4 (CuOH)2SO4 Cu(OH)2 CuOHNO3; NaHSO3 Na2SO3
183. Bi(NO3 )3 BiOH(NO3)2 Bi(OH)3 Bi2O3; Ca3(PO4)2 Ca3(H2PO4)2
184. Co(OH)2 CoOHCl CoCl2 Co(NO3)2; NaOH NaHSO3
185. Pb(NO3 )2 PbOHNO3 Pb(OH)2 K2PbO2; Na2Te NaHTe
186. NiCl2 Ni(OH)2 NiOHCl NiCl2; Ba(HS)2 BaS
187. CrOHCl2 CrCl3 Cr(OH)3 CrOHSO4; H2SiO3 NaHSiO3
188. (SnOH)2SO4 SnSO4 Sn(OH)2 Na2SnO2; K2SO3 KHSO3
189. NiBr2 NiOHBr Ni(OH)2 NiSO4; NaHSiO3 Na2SiO3
190. CoSO4 Co(OH)2 (CoOH)2SO4 Co(NO3)2; H2S Ca(HS)2
191. Cr2(SO4)3 CrOHSO4 Cr2(SO4)3 CrCl3; Mg3(PO4)2 MgHPO4
192. NiSO4 (NiOH)2SO4 Ni(OH)2 NiBr2; NaHCO3 Na2CO3
193. FeOHSO4 Fe2(SO4)3 Fe(OH)3 FeCl3; MgCO3 Mg(HCO3)2
194. Sn(OH)2 SnOHСl K2SnO2 Sn(OH)2; H3AsO4 KH2AsO4
195. NiBr2 Ni(OH)2 NiOHCl NiCl2; BaSO3 Ba(HSO3)2
196. Al(OH)3 Al(OH)2Cl AlCl3 Al(NO3)3; NaH2AsO3 Na3AsO3
197. CoCl2 Co(OH)2 (CoOH)2SO4 CoSO4; H2CO3 NaHCO3
198. Bi(OH)3 Bi(OH)2NO3 Bi(OH)3 Bi2O3; K2HPO4 H3PO4
199. Cu(OH)2 CuOHCl CuCl2 Cu(NO3)2; H2Se KHSe
200. CoSO4 (CoOH)2SO4 Co(OH)2 Co(NO3)2; K2SO3 KHSO3
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 9489; Нарушение авторских прав?; Мы поможем в написании вашей работы!