
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванические элементы
|
|
|
|
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.
Методика рассмотрения работы гальванических элементов:
· Составляют схему гальванического элемента:
(–) Me1 / Me1n + // Me2 m+ / Me2 (+)
· По уравнению Нернста находят потенциалы электродов.
· Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом.
· Записывают уравнения электродных процессов, определяют характер этих процессов.
· Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе.
· Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов.
Пример 1. Гальванический элемент с водородным электродом.
· Схема Zn / ZnSO4 // H2SO4, Н2 / Pt.
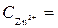 1 моль/л,
1 моль/л, 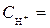 1 моль/л, Т = 298 К, P = 101,3 кПa.
1 моль/л, Т = 298 К, P = 101,3 кПa.
· Электродные потенциалы
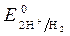 = 0 В,
= 0 В,  = - 0,76 В (при
= - 0,76 В (при 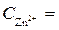 1 моль/л).
1 моль/л).
· Направление движения электронов во внутренней цепи - от цинкового электрода к водородному, так как потенциал цинкового электрода меньше.
ē 

(–) Zn / ZnSO 4 // H2SO4, Н2 / Pt (+)
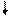 | |||
 |
SO42 -
· Уравнения электродных процессов:
Zn (-): Zn - 2 ē = Zn 2+ - процесс окисления;
Pt (+): 2Н ++ 2 ē = Н 2 - процесс восстановления.
· Суммарное уравнение:
Zn + 2Н + = Zn 2+ + Н 2 Zn + H2SO4 = ZnSO4 + Н 2
· Расчет величины ЭДС:
ЭДС = Е 0Ox - Е 0Red = 0 – (- 0,76) = 0,76 В.
Пример 2. Концентрационный гальванический элемент
Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации.
· Схема гальванического элемента:
Ni / NiSO 4(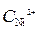 = 10-4 моль/л)// NiSO 4 (
= 10-4 моль/л)// NiSO 4 (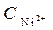 =1моль/л) / Ni
=1моль/л) / Ni
Стандартный электродный потенциал 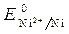 = - 0,25 В.
= - 0,25 В.
· Вычисление электродных потенциалов по уравнению Нернста:
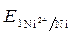 =
=  +
+ 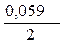 · lg
· lg  = - 0,25 +
= - 0,25 +  ·lg 10 - 4 = - 0,309 B.
·lg 10 - 4 = - 0,309 B.
 =
= 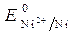 = - 0,25 B.
= - 0,25 B.
· Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как 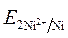 >
> 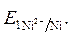
ē
 |
(-) Ni1 / NiSO4 (10 - 4 М) // NiSO4 (1 М) / Ni 2 (+)
 | |||
 |
SO42–
· Уравнения электродных полуреакций:
Ni1 (-): Ni - 2 ē = Ni 2+ - процесс окисления;
Ni2 (+): Ni2+ + 2 ē = Ni - процесс восстановления.
· Расчет величины ЭДС:
ЭДС = 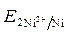 -
- 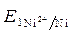 = - 0,25 - (- 0,309) = 0,059 В.
= - 0,25 - (- 0,309) = 0,059 В.
Задания к подразделу 4.3
Для предложенных гальванических элементов рассчитайте электродные потенциалы и ЭДС. Если концентрация раствора не указана, потенциал примите стандартным (табл.П.6). Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, составьте схему и укажите направления движения электронов и ионов.
301. Al / Al2(SO4)3, 0,005 M // NiSO4, 0,01 М / Ni
302. Ni / NiSO4, 0,1 M // H2SO4 / H2 (Pt)
303. Sn / SnSO4 // Cr2(SO4)3, 0,05 M / Cr
304. (Pt) H2 / H2SO4 // Al2(SO4)3, 0,005 M / Al
305. Cu / CuSO4, 0,1 M // H2SO4 / H2 (Pt)
306. Ag / AgNO3, 0,01 M // H2SO4 / H2 (Pt)
307. Co / CoSO4, 0,01 M // CoSO4 / Co
308. Zn / ZnSO4, 0,1 M // FeSO4, 0,01 M / Fe
309. Ag / AgNO3, 0,01 M // Zn(NO3)2 / Zn
310. (Pt) H2 / H2SO4 // ZnSO4, 0,01 M / Zn
311. Cd / Cd(NO3)2, 0,1 M // Cd(NO3)2, 0,001 M / Cd
312. Ni / NiSO4, 0,001 M // NiSO4 / Ni
313. Fe / FeCl2 // FeCl2, 0,01 M / Fe
314. Cr / Cr2(SO4)3, 0,005 M // ZnSO4 / Zn
315. Zn / Zn(NO3)2, 0,001 M // Zn(NO3)2 / Zn
316. Ag / AgNO3 // Cr(NO3)3, 0,005 M / Cr
317. Cd / CdCl2, 0,1 M // CuCl2, 0,1 M / Cu
318. Ti / Ti2(SO4)3, 0,5 M // CuSO4 / Cu
319. Sn / SnSO4, 0,01 M // Fe2(SO4)3 / Fe
320. Ag / AgNO3, 0,0001 M // Pb(NO3)2, 0,1 M / Pb
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1594; Нарушение авторских прав?; Мы поможем в написании вашей работы!