
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И растворами щелочей
|
|
|
|
Взаимодействие металлов с кислотами, водой
При взаимодействии металлов с агрессивными средами металл выступает в качестве восстановителя. Химическую активность (восстановительную способность) металла характеризует величина электродного потенциала.
Стандартным электродным потенциалом называют его электродный потенциал, возникающий при погружении металла в раствор собственной соли с концентрацией 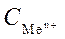 =1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25 0С условно принимается равным нулю.
=1 моль/л, измеренный по отношению к стандартному водородному электроду, потенциал которого при 25 0С условно принимается равным нулю.
Чем меньше значение 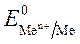 , тем большими восстановительными свойствами обладает данный металл.
, тем большими восстановительными свойствами обладает данный металл.
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов, получаем ряд стандартных окислительно-восстановительных потенциалов металлов (табл. П.6). В этом ряду все металлы условно делят на активные, средней активности и малоактивные:


 Li Rb K Cs Ba Sr Na Mg Be Al Mn Cr Zn Fe Cd Co Ni Sn Pb H2 Bi Cu Hg Ag Pt Au
Li Rb K Cs Ba Sr Na Mg Be Al Mn Cr Zn Fe Cd Co Ni Sn Pb H2 Bi Cu Hg Ag Pt Au
Активные металлы Средней активности Малоактивные
В роли окислителя в растворах кислот, щелочей и в воде выступает среда (потенциалы в табл. П.8). Реакции возможны, если потенциал окислителя больше потенциала восстановителя.
В нейтральной и щелочной среде в роли окислителя выступаетН2О:
2Н2О + 2 ē = Н2 + 2ОН —
В растворах разбавленных кислот (HCl, H2SO4) - окислитель Н+:
2Н + + 2 ē = Н2
В присутствии кислорода процесс восстановления протекает с участием кислорода, так как он обладает бóльшими окислительными свойствами, чемН2О и Н+: O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 + 4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
В H2SO4 (конц.) и HNO3 (разб.), HNO3 (конц.) окислителем являются анионы кислот. Степень восстановления анионов определяется активностью металла:
H2SO4 (конц.) + Me (активные) ® сульфат Ме + H2S + Н2О
H2SO4 (конц.) + Me (средней активности) ® сульфат Ме +S + Н2О
H2SO4 (конц.) + Me (малоактивные) ® сульфат Ме + SO2+ Н2О
HNO3 (разб.) + Me (активные) ® нитрат Ме + NH4NO3 + Н2О
HNO3 (разб.) + Me (средней активности) ® нитрат Ме +N2, N2O + Н2О
HNO3 (разб.) + Me (малоактивные) ® нитрат Ме + NO + Н2О
HNO3 (конц.) + Me (независимо от активности) ® нитрат Ме + NO2 + Н2О
Внимание! Три распространенных металла – Al, Cr, Fe – на холоде не растворяются в H2SO4(конц.) и HNO3(конц.). В этих кислотах они пассивируются, т. е. покрываются тонкой прочной пленкой, предохраняющей их от разрушения. Реакции протекают только при повышенной температуре.
Задание к подразделу 4.2
Используя потенциалы (табл. П.6, П.7, П.8), допишите уравнения реакций (по две для каждого варианта), составив к ним электронно-ионные схемы. Для реакций металлов с H2SO4 (конц.) и HNO3 значение потенциала окислителя более 1 В. Оцените практическую устойчивость металлов в данной среде.
| 281. а) Pb + KOH+ H2O + O2 б) Cu + H2SO4 (конц.) | 291. а)Al + HNO3 (разб.) б) Cr + NaOH + О2 |
| 282. а)Al + H2O + O2 б) Mg + HNO3 (разб.) | 292. а)Al + NaOH + H2O б) Cu + HNO3 (разб.) |
283. а)Al + HNO3 (конц.)  б) Sn + NaOH + O2 + H2O
б) Sn + NaOH + O2 + H2O
| 293. а)Al + H2SO4 (конц.)  б) Sn + H2O + O2
б) Sn + H2O + O2
|
| 284. а)Al + NaOH + H2O + O2 б) Zn + H2SO4 (конц.) | 294. а)Cr + NaOH + H2O б) Be + HNO3 (разб.) |
285. а)Al+HNO3 (конц.) 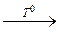 б) Zn + NaOH + H2O + O2
б) Zn + NaOH + H2O + O2
| 295. а)Fe + H2SO4 (конц.) 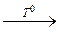 Fe3+
б) Al + H2O Fe3+
б) Al + H2O
|
| 286. а)Mg + H2O б) Zn + H2SO4 (разб.) + O2 | 296. а)Zn + HNO3 (конц.) б) Al + KOH+ H2O |
| 287. а)Fe + HNO3 (разб.) б) Zn + H2O + O2 | 297. а)Zn + H2SO4 (конц.) б) Co + NaOH+ H2O + O2 |
288. а)HNO3(разб.)+ Fe 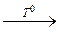 Fe3+
б) Zn + NaOH + H2O Fe3+
б) Zn + NaOH + H2O
| 298. а) Fe + HNO3(конц.) 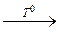 Fe3+
б) Al + H2O + O2 Fe3+
б) Al + H2O + O2
|
| 289. а)Zn + H2O + O2 б) Cu + H2SO4 (конц.) | 299. а)Zn + NaOH + H2O б) Cu + HNO3 (конц.) |
| 290. а)Zn + NaOH + H2O + O2 б) Cd + HNO3 (разб.) | 310. а)Zn + HNO3 (разб.) б) Cu + NaOH+ H2O + O2 |
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 587; Нарушение авторских прав?; Мы поможем в написании вашей работы!