
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основное уравнение молекулярно-кинетической теории идеальных газов
|
|
|
|
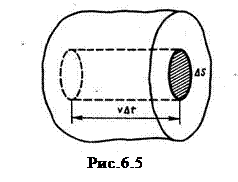 Рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку Δ S и вычислим давление на эту площадку. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс m 0 υ -(- m 0 υ) = 2 m 0 υ, где: т 0– масса молекулы, υ – ее скорость.
Рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку Δ S и вычислим давление на эту площадку. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс m 0 υ -(- m 0 υ) = 2 m 0 υ, где: т 0– масса молекулы, υ – ее скорость.
За время Δ t площадки Δ S достигнут только те молекулы, которые заключены в объеме цилиндра с основанием Δ S и высотой υ Δ t. Число этих молекул равно n Δ Sυ Δ t (n - концентрация молекул).
Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул, т.е. 1/6 часть, движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку Δ S будет 1/6 n Δ Sυ Δ t. При столкновении с площадкой эти молекулы передадут ей импульс
Δ P =2 m 0 υ∙  n Δ Sυ Δ t =
n Δ Sυ Δ t =  nm 0 υ2 Δ S Δ t
nm 0 υ2 Δ S Δ t
Тогда давление газа, оказываемое им на стенку сосуда,
p =Δ Ρ/ (Δ S Δ t) =  nm 0 υ2 (6.7)
nm 0 υ2 (6.7)
Если газ в объеме V содержит N молекул, движущихся со скоростями υ 1, υ 2,..., υN, то целесообразно рассматривать среднеквадратную скорость
υ cк= 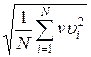 (6.8)
(6.8)
характеризующую всю совокупность молекул газа. Уравнение (6.7) с учетом (6.8) примет вид
p=  nm 0 υ cк 2 (6.9)
nm 0 υ cк 2 (6.9)
Выражение (6.9) называется основным уравнением молекулярно-кинетической теории идеальных газов.
Учитывая, что n=N/V,получим
pV=  Nm 0 υ cк 2,
Nm 0 υ cк 2,
или
pV=  N
N  =
= 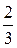 W, (6.10)
W, (6.10)
где W – суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm 0, то уравнение (6.9) можно переписать в виде
pV=  mυ cк 2.
mυ cк 2.
Для одного моля газа т=М (М — молярная масса), поэтому
pVm=  Mυ cк 2,
Mυ cк 2,
где Vm – молярный объем. С другой стороны, по уравнению Клапейрона - Менделеева, pVm=RT. Таким образом,
RT =  Mυ cк 2
Mυ cк 2
Откуда υcк = 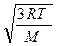 . (6.11)
. (6.11)
Так как М= NА m 0, где m 0 – масса одной молекулы, а NА – постоянная Авогадро, то из уравнения (6.11) следует, что
υcк= 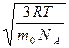 =
=  , (6.12)
, (6.12)
где: k=R/NA – постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют υcк =480 м/с, водорода – 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
< w 0> = 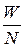 =
=  =
= 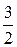 kТ (6.13)
kТ (6.13)
пропорциональна термодинамической температуре и зависит только от нее.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 525; Нарушение авторских прав?; Мы поможем в написании вашей работы!