
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
|
|
|
|
Введение в термодинамику
ОСНОВЫ ТЕРМОДИНАМИКИ
Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика базируется на трех началах – фундаментальных законах, установленных в результате обобщения опытных данных.
Термодинамика имеет дело с термодинамической системой – совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией между собой, так и с другими телами (внешней средой). Основа термодинамического метода – определение состояния термодинамической системы. Состояние системы задается термодинамаческими параметрами (параметрами состояния) – совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру T, давление P и объем V.
Важной характеристикой термодинамической системы является ее внутренняя энергия U – энергия теплового движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц.
Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
Введем понятие числа степеней свободы i: это число независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения (i =3). При этом энергию вращательного движения можно не учитывать.
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью. Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i =5). Трехатомнаяи многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных (i =6).
Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
На каждую степень поступательного движения приходится в среднем одинаковая энергия, равная 1/3 значения < w 0>:
< w 0>= 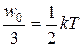 . (7.1)
. (7.1)
Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
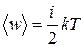 , (7.2)
, (7.2)
где i – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NА молекул:
Um 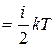 NА. (7.3)
NА. (7.3)
Внутренняя энергия для произвольной массы т газа
U 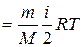
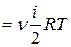 , (7.4)
, (7.4)
где Μ – молярная масса газа, ν – количество вещества.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 689; Нарушение авторских прав?; Мы поможем в написании вашей работы!