
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа газа при изменении его объема
|
|
|
|
Первое начало термодинамики
Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы или сообщения ей теплоты. Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U 1,получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U 2,совершила работу А над внешней средой. Количество теплоты считается положительным, когда оно подводится к системе, а работа – положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из одного состояния в другое изменение внутренней энергии Δ U=U 2 - U 1будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил:
Δ U=Q – A,или
Q= Δ U + A (7.5)
Уравнение (7.5) выражает первое начало термодинамики в интегральной форме: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Выражение (7.5) в дифференциальной форме будет иметь вид:
dQ=dU + dA,
или в более корректной форме:
δQ=dU+δA, (7.6)
где dU – бесконечно малое изменение внутренней энергии системы, δА — элементарная работа, δQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а δА и δQ таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (7.6).
Из формулы (7.5) следует, что в системе СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии Δ U =0. Тогда, согласно первому началу термодинамики, A = Q, т. е. вечный двигатель первого рода – периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, – невозможен.
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис.7.1).
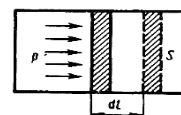 Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу
Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу
δA=Fdl=pSdl=p dV,
где S — площадь поршня, Sdl=dV — изменение
Рис.7.1 объема системы. Таким образом,
δA=p dV (7.7)
Полную работу А, совершаемую газом при изменении его объема от V 1до V 2 найдем интегрированием формулы (7.7):
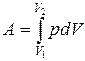 (7.8)
(7.8)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение справедливо при любых изменениях объема твердых, жидких и газообразных тел.

Рис.7.2
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении от объема V 1 до объема V 2 изображается кривой на рис.7.2.
При увеличении объема на dV совершаемая газом работа равна pdV,т. е. определяется площадью полоски с основанием dV,заштрихованной на рис.7.2. Поэтому полная работа, совершаемая газом при расширении от объема V 1до объема V 2 определяется площадью, ограниченной осью абсцисс, кривой p=f (V)и прямыми V 1и V 2.
Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1112; Нарушение авторских прав?; Мы поможем в написании вашей работы!