КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ВВЕДЕНИЕ. Цель работы: ознакомление с тонкой структурой спектра натрия и определение величины тонкого расщепления
|
|
|
|
ИЗУЧЕНИЕ ТОНКОЙ СТРУКТУРЫ СПЕКТРА ИЗЛУЧЕНИЯ ЩЕЛОЧНЫХ ЭЛЕМЕНТОВ
РАБОТА № 4
Цель работы: ознакомление с тонкой структурой спектра натрия и определение величины тонкого расщепления.
Приборы и принадлежности: дифракционный спектрограф ДФС-8, натриевая лампа, окулярный микрометр.
Атом щелочного элемента представляет собой сложную систему, состоящую из ядра (с зарядом Z), Z-1 электронов внутренних оболочек и внешнего (валентного) электрона. Электроны внутренних оболочек вместе с ядром образуют «остов» атома (атомный остаток), напоминающий ядро с зарядом Z = 1. Однако атомный остов не является точечным зарядом, поэтому уровни энергии валентного электрона, хотя и могут быть записаны в виде, подобном энергии электрона в атоме водорода:
E (n,L) = Rћc / n2эфф (1),
но nэфф уже не есть целое число:
nэфф = n + d (2).
Отличие nэфф от целого (квантовый дефект) d = nэфф - n зависит от величины орбитального квантового числа L, а именно, чем больше L, тем меньше квантовый дефект. Это обстоятельство легко объяснить на основе квантовой механики.
Действительно, волновая функция электрона, движущегося в центральном поле, пропорциональна rL на малых расстояниях r от центра поля. Поскольку квадрат модуля волновой функции пропорционален вероятности нахождения электрона в окрестности данной точки, то, как видим, вероятность нахождения электрона вблизи центра поля, т.е. внутри атомного остатка, тем меньше, чем больше его момент импульса L. Следовательно, электрон с большим моментом импульса движется преимущественно вдали от атомного остова и поэтому поправка d мала.
Можно дать и полуклассическую интерпретацию этому результату. Действительно, согласно классической механике, чем больше момент импульса электрона L, тем ближе его орбита к круговой. Это следует из того, что энергия частицы в центральном поле может быть записана в виде:
E=½ m d2r/dt2 + U(r) + L2 / 2m r2.
Последнее слагаемое (центробежная энергия) неограниченно возрастает по мере приближения частицы к центру поля, причем тем значительнее, чем больше L. Это и означает, что при больших значениях момента L частица движется преимущественно вдали от центра поля. Но в этом случае большую часть времени электрон проводит вдали от атомного остова, где поле мало отличается от поля точечного заряда[7]. А это, в свою очередь, означает, что поправка d мала. Зависимость E от L связана, как видим, именно с неточечностью атомного остова. В атоме водорода, где ядро является точечным зарядом, энергия зависит лишь от n, а от L не зависит совсем. Поэтому говорят, что уровни энергии атома водорода вырождены по L, то есть все состояния с одинаковыми n и разными L имеют одинаковую энергию. Кроме того, все уровни атомов, за исключением уровней с L = 0, представляют собой дублеты, т.е. каждый уровень расщепляется на два. Это расщепление очень мало у водорода, несколько больше у лития и растет с ростом атомного номера элемента. Расщепление уровней носит название тонкой структуры атомных уровней[8]. Оно связано с наличием у электронов спина и взаимодействием спинового магнитного момента с орбитальным магнитным моментом.
Как и в спектре водорода длины волн, соответствующие линиям каждой серии, могут быть описаны общей сериальной формулой, называемой формулой Ридберга:
1 / l i k = R (1/ n i эфф 2 - 1 / n k эфф 2) (3),
где ni эфф = ni +di, nk эфф = nk + dk - эффективные квантовые числа. В спектрах щелочных элементов существуют серии, расположенные в ультрафиолетовой, видимой и инфракрасной областях.
Главная серия: представляет собой переходы с nР-уровней на основной уровень S. Переменным термом является р-терм. Обозначение термов происходит от названия серии "principal" - главный. Для натрия эта серия записывается в виде (поправки d обозначены S и P):
1 / l = R[1 / (3+s)2 - 1 / (n+p) 2] (4),
где n = 3,4,5,...
Первая побочная, или диффузная серия с размытыми линиями представляет собой переходы с D-уровней на Р-уровень. Переменным является D-терм. Обозначение термов происходит от названия серии "diffuse" - размытый. Схема структуры серии записывается для натрия:
1 / l = R[1 / (3+p)2 - 1 / (n+d) 2] (5),
где n = 3,4,5,...
Вторая побочная, или резкая серия с резко очерченными краями линий представляет собой переходы с наиболее глубоких S-уровней на Р-уровень. Переменным термом является S-терм. Обозначение термов происходит от названия "sharp" -резкий. Схема структуры серии записывается для натрия:
1 / l = R[1 / (3+p)2 - 1 / (n+s) 2] (6),
где n = 4,5,...
Серия Бергмана, или фундаментальная серия расположена в инфракрасной области спектра.и представляет собой переходы между наиболее глубокими F-уровнями и D-уровнем. Переменным является F-терм. Обозначение терма происходит от названия серии "fundamental"- фундаментальная. Схема структуры линий серии натрия выражается
1 / l = R[1 / (3+d) 2 - 1 / (n+s) 2] (7),
где n = 4,5,...
В приведенных формулах величины s,p,d,f- некоторые параметры, которые с хорошей точностью можно считать постоянными для каждой серии. Линии серий образованы переходами электрона между термами, для которых выполняются правила отбора для квантовых чисел J и L:
DJ = 0, ± 1, DL = ± 1 (8).
В результате линии главной и второй побочной серий - двойные, а линии остальных серий (первая побочная, серия Бергмана) образуют более сложные группы линий (мультиплетное расщепление). Кроме указанных серий в спектре натрия наблюдаются так называемые «запрещенные линии», например с длиной волны l=3427,1А.[9]
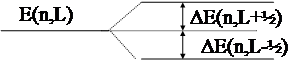
Как и в атоме водорода, дублетное и мультиплетное расщепление спектральных линий щелочных элементов и структура спектральных термов определяется магнитным взаимодействием орбитального L и спинового S моментов электрона, т.е. релятивистскими эффектами. Для двух дублетных уровней, на которые расщепляется данный терм щелочного элемента, квантовое число J принимает два значения:
J = L+ ½ и J = L – ½ при n³ 1 (см. Рис. 1).
Тогда энергии, соответствующие этим значениям J оказываются следующими:
DE(n,L+½) = ½ L x(n,L), (J=L+½), (9)
DE(n,L-½) = - ½ (L+1) x(n,L), (J=L-½).
x(n,L) = R ћ c Z эфф 4a2/n3 L (L+ ½)(L+1), (10)
|
Постоянная a = e2/ћc = 1/137,039 называется постоянной тонкой структуры. Малая величина этой постоянной характеризует слабость магнитного спин-орбитального взаимодействия, определяющего тонкое расщепление атомных уровней. Более подробно по поводу этой формулы см. Приложение к работе.
Величины DE(n,L+ ½) и DE(n,L - ½) определяют сдвиг дублетных уровней вследствие спин-орбитального взаимодействия. Разность волновых чисел (волновым числом в спектроскопии называют величину, обратную длине волны: n=1/l, здесь и далее l измеряется в сантиметрах) линий дублета дается выражением:
Dn = [ DE(n,L+ ½) - DE(n,L - ½)]/ 2p ћ = x(n,L) (L+ ½) / 2pћc =
=5,83×Z эфф 4 / n3×L×(L+1) (11).
Формулу (11) можно использовать для определения значения эффективного заряда Zэфф и постоянной экранирования a=Z‑Z эфф.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!