
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Горение углерода
|
|
|
|
Горение топлива
Процессы горения используются для получения тепла и высоких температур. Для этого реакции горения должны сопровождаться значительным выделением тепла и протекать с высокой скоростью.
В качестве топлива обычно используют горючие вещества органического происхождения: кокс, мазут, горючие газы. Химическая сторона горения топлива сводится главным образом к многочисленным реакциям взаимодействия углерода, водорода и соединений, содержащих эти элементы, с кислородом.
Для металлургических процессов наиболее важны следующие реакции:
1. Полное горение углерода: С (т) +О 2(г) = СО 2(г); тепловой эффект реакции Δ Н 1 = -393707Дж;
2. Неполное горение углерода: 2 С (т) + О 2(г) = 2 СО (г); Δ Н 2 = -283190Дж;
3. Горение окиси углерода: 2 СО (г) + О 2(г) = 2 СО 2(г); Δ Н 3 = -110610Дж;
4. Взаимодействие углекислого газа с углеродом: С (т) +СО 2(г) = 2 СО (г);
5. Горение водорода: 2 Н 2(г) + О 2(г) = 2 Н2О (г);
6. Взаимодействие водяного пара с углеродом: Н 2 О (г) + С (т) = СО (г) + Н 2(г);
7. Взаимодействие водяного пара с углеродом с образованием двуокиси углерода: 2 Н 2 О (г) +С (т) = СО 2(г) + 2 Н 2(г);
8. Реакция водяного пара: СО 2(г) + Н 2(г) = СО (г) + Н 2 О (г).
Реакции 3, 5, 8 – гомогенные, остальные – гетерогенные.
Взаимодействие углерода с кислородом описывается реакциями 1-4. Это взаимодействие имеет место во многих металлургических системах. Рассмотрим его на примере процесса ваграночной плавки. В условиях слоевого взаимодействия углерода (кокса) с кислородом и продуктами горения происходит сложный гетерогенный процесс, конечные результаты которого оказывают влияние на особенности химических реакций, физического переноса газообразных компонентов к поверхности твердого топлива и отвода продуктов реакций.
Реакции 1, 2 и 3 могут протекать в окислительных условиях, то есть когда в реагирующем пространстве имеется достаточное количество свободного кислорода. Реакция 4 протекает в восстановительных условиях, то есть когда имеется избыток углерода (или дефицит кислорода). Максимальное выделение теплоты характерно для реакции 1. Причем Δ Н 1 = Δ Н 2 + Δ Н 3 (закон Гесса).
Термодинамический анализ рассматриваемых реакций позволяет оценить условия их преимущественного развития и прочность получаемых при этом химических соединений.
Рассмотрим температурную зависимость изменения изобарно-изотермических потенциалов реакций, представленную на рис. 6.

Рис. 6. Температурная зависимость 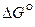 реакций горения углерода
реакций горения углерода
Отрицательные значения  являются показателем того, что реакция 1 самопроизвольно развивается в стандартных условиях. Большое числовое значение
являются показателем того, что реакция 1 самопроизвольно развивается в стандартных условиях. Большое числовое значение 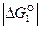 характеризует значительную степень сродства углерода и кислорода и прочность образовавшегося углекислого газа СО 2. Реакция 1 завершается с большой степенью полноты, является необратимой, а полученный углекислый газ не может разлагаться с выделение углерода.
характеризует значительную степень сродства углерода и кислорода и прочность образовавшегося углекислого газа СО 2. Реакция 1 завершается с большой степенью полноты, является необратимой, а полученный углекислый газ не может разлагаться с выделение углерода.
Числовые значения 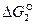 показывают, что при высоких температурах проявляется значительное химическое родство углерода и кислорода с образованием СО. Реакция необратима. С повышением температуры прочность СО возрастает. При понижении температуры прочность СО понижается и возрастает сродство СО и кислорода по реакции 3.
показывают, что при высоких температурах проявляется значительное химическое родство углерода и кислорода с образованием СО. Реакция необратима. С повышением температуры прочность СО возрастает. При понижении температуры прочность СО понижается и возрастает сродство СО и кислорода по реакции 3.
Положение прямой температурной зависимости 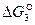 в области пониженных числовых значений сродства СО и О 2 и уменьшение ее с повышением температуры является свидетельством неполного завершения реакции и ее обратимости. Следовательно, диссоциация углекислого газа СО 2 возможна только с образованием СО и О 2, но невозможна с выделением свободного углерода.
в области пониженных числовых значений сродства СО и О 2 и уменьшение ее с повышением температуры является свидетельством неполного завершения реакции и ее обратимости. Следовательно, диссоциация углекислого газа СО 2 возможна только с образованием СО и О 2, но невозможна с выделением свободного углерода.
При диссоциации СО образуется углерод и углекислый газ и невозможно выделение свободного кислорода.
Константы равновесия реакций 1 и 2:
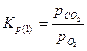
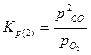
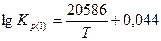

В реальных условиях в той или иной степени получают развитие все четыре реакции. При этом следует учитывать не только химические, но и физические особенности процесса. В газовой фазе, кроме диффузионного взаимодействия, имеет место конвективный перенос О 2, СО и СО 2. Кокс, используемый в большинстве случаев в качестве топлива в вагранках, характеризуется определенной степенью пористости. Газовые реагенты проникают в макро- и микропоры, в которых развиваются те или иные химические реакции, идет так называемое внутреннее реагирование. В сложной цепи химических реакций имеются звенья, определяющие кинетику всего процесса. В условиях слоевого горения топлива таким звеном является суммарный расход кислорода на химические реакции и диффузионный перенос его в реакционную зону.
Если преимущественным является процесс окисления углерода внутри топлива в порах и трещинах, то узким звеном процесса является перенос кислорода во внутрь кусков топлива, где преимущественно происходит окисление углерода до СО. Если в газовой фазе имеется избыток кислорода, то образовавшийся СО может догореть до СО 2. При этом задерживается доставка кислорода во внутренние слои топлива и создается его дефицит.
При слоевом горении твёрдого углеродсодержащего топлива различают две переходящие друг в друга зоны: окислительную и восстановительную.
Окислительная или кислородная зона начинается от границы первичного взаимодействия с дутьем и продолжается вглубь до того места, где в газовой фазе исчезает свободный кислород. В этой зоне образуются СО 2 и СО. С понижением в газовой фазе концентрации кислорода в ней увеличивается количество СО. В связи с отсутствием в газовой фазе кислорода в слое топлива развивается эндотермическая реакция 4 взаимодействия СО 2 и С.
Максимальной концентрации СО 2 в слое топлива соответствует и наибольшая температура. По мере увеличения в газовой фазе СО температура в слое топлива понижается.
Установлено, что длина кислородной зоны мало зависит от скорости дутья. Концентрация СО в газовой фазе в значительной степени зависит от температурного режима.
Изменение состава газовой фазы сопровождается изменением её свойств. При увеличении в ней концентрации СО её восстановительные свойства увеличиваются, а окислительные уменьшаются.
В зависимости от соотношения в газовой фазе СО 2 и СО, она в одном случае может быть источником углерода и науглероживать металлы и сплавы, в других - поглощать углерод и обезуглероживать металлы и сплавы.
Горение водорода и оксида углерода СО протекают по цепному механизму. Особенность горения СО состоит в том, что её скорость существенно зависит от содержания в системе водорода и водяных паров. Реакция водяного газа в прямом и обратном направлениях идёт в присутствии твердых катализаторов.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 9351; Нарушение авторских прав?; Мы поможем в написании вашей работы!