
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Восстановление оксидов железа
|
|
|
|
1. Восстановитель СО. Реакции восстановления оксидов железа могут быть представлены в следующем виде:
3 Fe 2 O 3 + CO → 2 Fe 3 O 4 + CO 2; ∆H 1= - 53, 74 кДж;
Fe 3 O 4 + CO↔ 3 FeO + CO 2; ∆H 2= 36, 68 кДж;
FeO +CO↔ Fe + CO 2; ∆H 3= - 16, 26 кДж.
Эти реакции протекают последовательно при температуре выше 570°С. При более низкой температуре железо восстанавливаетсянепосредственно из магнитной окиси железа Fe 3 O 4 по реакции:
1/4 Fe 3 O 4 +CO↔ 3/4 Fe + CO 2; ∆H 4= - 2,87 кДж.
Для всех реакций 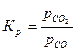 .
.
Числовые значения констант равновесия реакций восстановления железа понижаются скачком при переходе от высших оксидов к низшим.
2. Восстановитель твёрдый углерод. Реакции восстановления:
3 Fe 2 O 3 + C → 2 Fe 3 O 4 + CO; ∆H 1= 118,82 кДж;
Fe 3 O 4 + C→ 3 FeO + CO; ∆H 2= 209,26 кДж;
FeO +C→ Fe + CO; ∆H 3= 156,50 кДж.
Реакция прямого восстановления в общем виде:
МеО + С ↔ Ме + СО.
Реакция между двумя твёрдыми компонентами оксидом и твёрдым углеродом ограничивается из-за недостаточного контакта между их поверхностями и низкой скоростью диффузии углерода в твёрдом оксиде.
В условиях пониженных температур реакция прямого восстановления может иметь вид:
2 МеО + С ↔ 2 Ме + СО 2.
Если в процессе восстановления оксида углеродом происходит образование карбида, то состав равновесной газовой фазы смещается в сторону меньшего содержания СО и понижается температура начала восстановления.
3. Восстановитель - металл Ме'', обладающий более высоким химическим сродством к кислороду, чем металл Ме' восстанавливаемого оксида.
Ме'О + Ме'' ↔ Ме' + Ме''О.
Для этой реакции ∆G° = ½ (∆G°Ме''О - ∆G°Ме'О).
Восстановление будет протекать, если 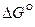 <0, т.е.
<0, т.е.  >
> 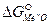 .
.
Система будет находиться в равновесии, если 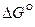 =0;
=0;  =
= 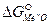 .
.
Следовательно, полнота завершения реакции восстановления оксида металлом будет тем большей, чем больше разница в величине приращения изобарного потенциала  для образующегося и восстанавливаемого оксидов.
для образующегося и восстанавливаемого оксидов.
Большое значение в протекании процессов восстановления оксидов имеют разнообразные кинетические факторы.
ЗАКОНОМЕРНОСТИ ВЗАИМОДЕЙСТВИЯ МЕТАЛЛИЧЕСКИХ И ШЛАКОВЫХ РАСПЛАВОВ
В процессах черной металлургии участвуют две несмешивающиеся жидкие фазы с различным удельным весом: металл – расплав железа, содержащий другие элементы, и шлак – расплав оксидов и солей.
Взаимодействие между этими фазами имеют первостепенное значение, но изучение процессов с участием расплавов весьма затруднительно, так как они протекают при высоких температурах.
Для изучения процессов с участием расплавов важно знать их строение, то есть природу частиц, образующих жидкость и энергию их взаимодействия.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 865; Нарушение авторских прав?; Мы поможем в написании вашей работы!