
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Восстановление металлов из оксидов
|
|
|
|
Образование оксидных фаз
Образование оксидных фаз – это процесс, обратный рассмотренному выше процессу диссоциации оксидов. В общем виде он описывается уравнением реакции
2 Ме (т) + О 2 = 2 МеО (т).
В плавильных агрегатах твердая металлическая шихта еще до расплавления часто подвергается длительному воздействию окислительной атмосферы. В результате на ней образуется слой оксидов. Образующийся оксид является самостоятельной конденсированной фазой, которая препятствуют дальнейшему непосредственному контакту металла с окислительной газовой фазой. При расплавлении металлических материалов оксидная фаза может расплавиться и перейти в шлак или остаться в растворённом металле.
Скорость окисления и рост оксидной фазы обуславливается механизмом переноса реагирования веществ внутри уже образовавшегося слоя оксидов и реакциями на межфазных границах.
Превращения, которые сопровождаются исчезновением одних и возникновением других твёрдых тел, относятся к классу топохимических реакций, у которых основные взаимодействия протекают на поверхности раздела кристаллических фаз.
Процесс окисления является сложным и многостадийным. Развитие его связано с толщиной и природой имеющейся или образующейся оксидной фазы и возможностью протекания в ней диффузионных процессов.
Оксиды таких металлов, как алюминий, свинец, цинк, никель, хром, железо характеризуются большим молекулярным объемом по сравнению с атомным объемом металла, израсходованного на их образование (V Meo – V Me > 0). На таких металлах образуются сплошные плотно прилегающие оксидные слои, которые обладают высокими защитными свойствами от окисления.
Если V Meo – V Me < 0, то образуется пористый слой оксидов, не оказывающий диффузионного сопротивления, через него окислительный газ легко проникает к поверхности оксид-металл. Это наблюдается у кальция, натрия, кадмия и др. металлов.
Если происходит окисление металлов, образующих различные оксиды, то они располагаются послойно в соответствии с термодинамическими свойствами. Например, железо с кислородом образует оксиды FeO, Fe 3 O 4, Fe 2 O 3. Обычно к металлу прилегают оксиды FeO, а в наружном слое образуется Fe 2 O 3. При повышенных температурах преимущественно образуется FeO, при температурах ниже 570°С большую часть окалины составляет Fe 3 O 4.
Многие процессы выплавки сплавов завершаются операцией освобождения сплавов от избытка кислорода - раскислением. Удаление кислорода из оксида, растворенного в металлическом расплаве, или восстановление оксидов, находящихся в шлаке, определяет качество и свойства металла.
Для того чтобы произошло разложение оксида и выделение из него металла необходимо, чтобы упругость диссоциации оксида была больше парциального давления кислорода в газовой фазе, то есть
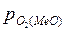 >
> 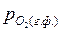 .
.
Вакуумирование пространства над расплавом не обеспечивает это условие. Более эффективным способом является химическое связывание кислорода с помощью элементов, обладающих большей степенью химического сродства к кислороду, чем восстанавливаемый металл. Оценить эффективность элементов-восстановителей, можно по величине изменения изобарно-изотермического потенциала 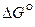 образования оксидов.
образования оксидов.
На практике в качестве восстановителей используют твёрдый углерод С, СО, Н 2, многокомпонентные газовые природные смеси и др.
Термодинамически процесс восстановления может быть представлен в виде совокупности двух обратимых реакций: взаимодействия металла и восстановителя с кислородом.
Если восстановителем является СО, то реакции имеют вид:
2 МеО↔ 2 Ме + О 2( ),
),
2 СО 2 ↔ 2 СО + О 2(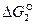 ).
).
Итоговая реакция получается при вычитании реакции 2 из реакции 1:
МеО + СО ↔ Ме + СО 2(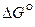 ).
).
Изобарно-изотермический потенциал итоговой реакции
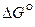 = ½ (
= ½ ( -
- 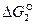 ).
).
Константы равновесия реакций 1 и 2:
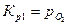 ,
,  .
.
Завершенность реакции характеризуется равновесным состоянием газовой фазы.
Направление процесса и суммарный результат 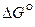 будут определяться соотношением величин
будут определяться соотношением величин  и
и 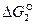 . Величина и знак
. Величина и знак 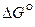 процесса определяются свойствами реагирующих оксидов и составом газовой фазы в начальном и конечном состояниях.
процесса определяются свойствами реагирующих оксидов и составом газовой фазы в начальном и конечном состояниях.
Если условия реагирования отличны от стандартных, то на величину 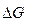 оказывает влияние исходный составов системы.
оказывает влияние исходный составов системы.
Условия протекания процессов в рассматриваемой системе:
1). Восстановление оксида, если 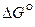 <0, т.е.
<0, т.е. 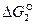 >
>  ;
;
 ;
;  .
.
2). Окисление металла, если 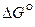 >0, т.е.
>0, т.е. 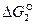 <
<  ;
;
 ;
; 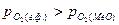 .
.
3). Равновесное состояние. 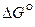 =0, т.е.
=0, т.е. 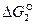 =
=  ;
;
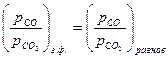 ;
; 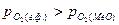 .
.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1860; Нарушение авторских прав?; Мы поможем в написании вашей работы!