
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диффузионные процессы
|
|
|
|
Стадии и режимы гетерогенных процессов
Большинство реакций металлургических процессов протекают между веществами, которые находятся в различных соприкасающихся фазах, поэтому они называются гетерогенными.
Гетерогенные реакции имеют наибольшее значение в следующих процессах: горение топлива, восстановление твердых оксидов углеродом или газами, распределение веществ между жидкими несмешивающимися фазами (металлы и шлаки), растворение газов в металлах и шлаках, дегазация (обратная реакция растворению), растворение твёрдых тел в жидкостях, кристаллизация расплавов, различные превращения в твердых металлах и сплавах.
Гетерогенные процессы сложны и протекают в несколько стадий (по меньшей мере три):
I стадия - перенос реагирующих веществ к реакционной зоне (поверхности раздела фаз);
II стадия - собственно гетерогенная химическая реакция;
III стадия - отвод продуктов реакции из зоны реагирования.
Во всех стадиях скорости процессов пропорциональны величине поверхности раздела фаз. Следовательно, скорости гетерогенных реакций зависят от отношения величин поверхности раздела фаз к их объёму.
Суммарная скорость гетерогенного процесса определяется скоростями отдельных стадий. Скорость процесса определяет стадия с наименьшей скоростью.
Если самой медленной стадией процесса является подвод реагирующих веществ в зоне реакции или отвод из нее продуктов реакции, то процесс протекает в диффузионном режиме, в диффузионной области.
Если стадия с наименьшей скоростью связана с химическим или физическим превращением, то скорость процесса определяется скоростью реакции, процесс протекает в кинетическом режиме, в кинетической области.
В случае сравнимых скоростей диффузии и химического превращения процесс протекает в промежуточной области.
Диффузией называется процесс самопроизвольного распространения вещества в какой-либо газообразной, жидкой или твёрдой среде. Явления такого типа, связанные с переносом масс, обуславливаются, главным образом, тепловым движением молекул и атомов.
В газообразном и жидком веществах перемена мест атомов и молекул происходит сравнительно легко вследствие того, что связи между этими частицами ослаблены или полностью нарушены. В твердых кристаллических телах положения атомов фиксированы в узлах кристаллической решетки, и перемещения отдельных атомов вещества происходит менее интенсивно, чем в жидкости или газе.
Для развития диффузии в металле нужно, чтобы диффундирующее вещество образовывало с ним твёрдый раствор. Атомы самого металла также перемещаются и меняются местами при тепловом движении, этот процесс называется самодиффузией.
Чаще всего диффузия протекает в направлении снижения концентрации вещества, но в некоторых условиях может идти и в сторону ее повышения. В первом случае происходит равномерное распределение вещества по объёму растворителя, во втором случае - разделение компонентов.
В твёрдых металлах возможны три пути диффузии атомов в решетке растворителя:
- за счёт простого обмена местами соседних атомов;
- вследствие проникновения атомов в пространство между узлами кристаллической решетки;
- путём перемещения вакансий, в результате которого происходит и перемещение атомов.
Диффузия преимущественно осуществляется по третьему пути.
Скорость диффузии определяется количеством вещества, диффундирующего через единицу площади поверхности раздела фаз за единицу времени. Согласно первому закону Фика:
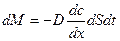 (49)
(49)
количество вещества dM, продиффундировавшего за время dt через элемент поверхности dS пропорционально градиенту концентрации  .
.
Закон Фика справедлив для малых концентраций и диффундирующего вещества, далеких от концентрации насыщения.
Знак «-» в уравнении показывает, что диффузия протекает в направлении убывания концентрации (направление градиента концентрации не совпадает с направлением диффузии).
Коэффициент пропорциональности D [см2/с] называется коэффициентом диффузии. Коэффициент диффузии – количество вещества, диффундирующего через единицу площади за единицу времени при перепаде концентрации, равной единице. Зависит он от природы сплава, размера зерна и особенно сильно от температуры. Температурная зависимость коэффициента диффузии подчиняется экспоненциальному закону:
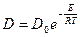 , (50)
, (50)
где Do – предэкспоненциальный множитель, величина которого определяется типом кристаллической решетки; E – энергия активации процесса, ккал/г-ат.; R - газовая постоянная; T – температура, К.
Энергия активации диффузии характеризует энергию связи атомов в кристаллической решётке. Чем выше значение Е, тем больше величина энергии, необходимой для перехода атома из первого равновесного положения кристаллической решетки в другое такое же равновесное положение. Требуемый для перехода избыток энергии приобретается атомом от его соседей благодаря непрерывному обмену кинетической энергией с соседними атомами.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1955; Нарушение авторских прав?; Мы поможем в написании вашей работы!