
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы к экзамену и зачету 1 страница
|
|
|
|
Основные понятия и законы химии
1. Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.
Химия – это наука о превращениях веществ. Она изучает строение вещества, зависимые свойства веществ от их строения и состава, условия и пути превращения одних веществ в другие.
Вещество — физическая субстанция со специфическим химическим составом.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Атом – это наименьшая частица элемента, обладающая его химическими свойствами.
Моль – это количество вещества, содержащее столько же частиц, сколько содержится атомов углерода в 0,012 кг углерода.
2. Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона.
Закон сохранения масс (открыт Ломоносовым): масса веществ, вступивших в реакции равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии. Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.
Закон постоянства состава: соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способов получения этого соединения.
Закон Авогадро: в равных объёмах любых газов, взятых при одной о той же температуре и при одинаковых давлениях содержится одно и то же число молекул. NA = 6,02*1023 моль-1
Закон кратных отношений: если 2 элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количеством другого элемента относятся между собой, как небольшие целые числа.
Законы простых объёмных отношений: объёмы вступающих в реакцию газов относятся друг к другу, а также к объёму получающихся газообразных продуктов как небольшие целые числа.
Парциальное давление каждого газа, входящего в состав смеси, это давление, которое создавалось бы той же массой данного газа, если он будет занимать весь объем смеси при той же температуре.
3. Эквивалент элемента и вещества. Закон эквивалентов.
Эквивалентом элемента (соединения) называют такое массовое количество его, которое соединяется с одной массовой частью водорода или восемью массовыми частями кислорода или же замещает эти количества в соединениях. Э=А\В [моль].
Эквивалент вещества — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-основных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях.
Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
4. Расчет молярной массы эквивалента простого и сложного вещества.
Для простого одноатомного вещества (например: Mg, P, S и т.д.) z * равно наиболее характерной валентности В элемента простого вещества. Тогда
М Э (Х) = 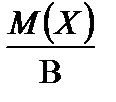 .
.
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
| М Э(оксида) = М Э(элемента) + М Э(О) = М Э(элемента) + 8 М Э(кислоты) = М Э(Н) + М Э(кислотного остатка) = 1 + М Э(кислотного остатка) М Э(основания) = М Э(Ме) + М Э(ОН) = М Э(Ме) + 17 М Э(соли) = М Э(Ме) + М Э(кислотного остатка). |
5. Уравнение Менделеева-Клапейрона, основные газовые законы.
Уравнение Менделеева — Клапейрона — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
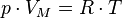 ,
,
где
-
 — давление,
— давление, -
 — молярный объём,
— молярный объём, -
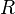 — универсальная газовая постоянная
— универсальная газовая постоянная -
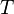 — абсолютная температура, К.
— абсолютная температура, К.
Так как 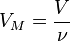 , где
, где 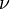 — количество вещества, а
— количество вещества, а  , где
, где 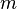 — масса,
— масса, 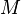 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:

Основные газовые законы:
Изопроцесс - это идеализированная модель реального процесса, которая только приближенно отражает действительность.
Изотермический процесс. Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим. Согласно уравнению состояния идеального газа в любом состоянии с неизменной температурой произведение давления газа на его объем остается постоянным:

Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой (рис.10.1).

Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным Согласно уравнению в любом состоянии газа с неизменным давлением отношение объема газа к его температуре остается постоянным:

Зависимость графически изображается прямой, которая называется изобарой (рис.10.2). Разным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля - Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению p2, лежит ниже изобары, соответствующей более низкому давлению p1.

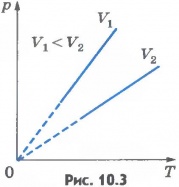
Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Из уравнения состояния вытекает, что в любом состоянии газа с неизменным объемом отношение давления газа к его температуре остается постоянным:

Зависимость изображается прямой, называемой изохорой (рис.10.3). Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление его согласно закону Бойля - Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1.
Строение и свойства атомов
1. Квантово-механическая модель (КММ) строения атома, уравнение де Бройля, принцип Гейзенберга, волновая функция, уравнение Шредингера.
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
| Квантовое число | Символ | Описание | Значения |
| Главное | n | Энергетический уровень орбитали | Положительные целые числа: 1, 2, 3... |
| Орбитальное | l | Форма орбитали | Целые числа от 0 до n-1 |
| Квантовое | m | Ориентация | Целые числа от -l до +l |
| Спиновое | ms | Спин электрона | +½ и -½ |
Уравнение де Бройля. Волновые свойства частицы определяются по формуле. λ=h/mV (λ – длина волны, h – постоянная Планка (6,62х10-34 Дж/сек), m,V – масса/скорость частицы).
Принцип Гейзенберга. Основная идея – невозможно в любой данный момент времени определить и положение в пространстве, и импульс электрона. Математически это выражается так: Здесь ∆px – неопределенность по величине импульса, а ∆х – неопределенность расположения частицы в пространстве» 
2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (АО).
1. Главное квантовое число n характеризует основной запас энергии электрона и размер электронного облака. Оно может принимать только целочисленные значения от 1 до +¥. Чем больше значение n, тем больше размер электронного облака и выше его энергия. Электроны, имеющие одинаковые значения n, образуют электронные слои (иначе - энергетические уровни), которые обозначают буквами
| Значение n | |||||||
| Уровень | K | L | M | N | O | Р | Q |
2. Орбитальное (иначе побочное) квантовое число l определяет момент количества движения электрона и характеризует форму электронного облака. l изменяется в пределах от 0 до (n – 1). Каждому значению l соответствует своя форма электронного облака: при l = 0 – сферическая; l = 1 – гантелевидная; l = 2 – две пересекающиеся под прямым углом гантели; l = 3 – три пересекающиеся под прямым углом гантели (см. табл. 2).
Электроны одного энергетического уровня, имеющие одинаковые значения l, образуют энергетические подуровни, которые имеют буквенные обозначения (см. табл. 2).
Состояние электрона с определенными значениями n и l записывают в виде сочетания цифрового значения n и буквенного l. Например, при n = 3 и l = 1 записывают 3 p, а при n = 4 и l = 3 записывают 4 f.
3. Магнитное квантовое число ml характеризует положение электронного облака в пространстве. ml изменяется в пределах от – l до + l, т.е. всего в каждом подуровне оно может принимать (2 l + 1) значений, количество которых показывает число возможных положений электронного облака данного типа в пространстве. Все орбитали одного подуровня обладают одинаковой энергией и называются вырожденными.
Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n, l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде черты ---, которые называют энергетической ячейкой.
4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ () и ms = – ½ ().
Атомная орбиталь — одноэлектронная волновая функция, задаётся главным n, орбитальным l и магнитным m квантовыми числами или это условная орбита, по которой электроны вращаются вокруг ядра.
3. Строение многоэлектронных атомов: принципы и правила размещения электронов в атоме. Исключения из правила Клечковского.
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правила Гунда (Хунда) и Клечковского.
Принцип минимальной энергии: электроны в невозбужденном атоме распределяются по орбиталям таким образом, чтобы суммарная энергия атома была минимальной. Первыми заполняются орбатали с минимальными уровнями энергии.
Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме n + l в порядке возрастания n. Соответственно этому правилу подоболочки выстраиваются в следующий ряд:
1s < 2s < 2p < 3s < 3p < 4s» 3d < 4p < 5s» 4d < 5p < 6s» 5d» 4f < 6p < 7s и т. д.
Исключение составляют d- и f-элементы с полностью и наполовину заполненными подоболочками, у которых наблюдается так называемый «провал электронов», например Cu, Ag, Cr, Mo, Pd, Pt.
Принцип запрета Паули (1925): на одной атомной орбитали (в одной квантовой ячейке) не может быть более двух электронов, причем они должны иметь противоположные (антипараллельные) спины. По-другому можно сказать: в атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел n, l, ml, и ms. Поэтому допускается заполнение ¯ и не допускается заполнение и ¯ ¯.
Правило Гунда (Хунда): при наличии нескольких пустых или наполовину заполненных ячеек данного подуровня электроны занимают максимально возможное число пустых ячеек. Следовательно, заполнение орбиталей одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данной подоболочке, заполняются орбитали вторыми электронами с противоположными спинами.
Электронные конфигурации элемента. Обычно электронная конфигурация приводится для основного состояния атома. В случае, когда один или несколько электронов находятся в возбужденном состоянии, то и электронная конфигурация будет характеризовать возбужденное состояние атома.
При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами – подоболочки (s,p,d, или f), а степень буквенных обозначений подоболочек обозначает число электронов в данной подоболочке. Например, электронная конфигурация водорода-1s1, лития – 1s22s1, бора – 1s22s22p1, титана – 1s22s22p63s2 3p63d24s2, цезия – 1s22s22p63s23p63d104s24p64d105s25p65d106s1.
4. Окислительно-восстановительные свойства атомов и ионов: энергия ионизации, энергия сродства к электрону, электроотрицательность, орбитальный радиус.
Окислительно-восстановительные реакции.
а) Окислением называют процесс отдачи электронов атомам, молекулам или ионам. Степень окисления при этом повышается.
б) Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
в) Атомы, молекулы и ионы, отдающие электроны называются восстановителями. Сами они при этом окисляются. Атомы, молекулы и ионы, присоединяющие электроны называются окислителями. Сами они при этом восстанавливаются.
г) Окисление всегда сопровождается восстановлением (и наоборот).
Для отрыва электрона от атома необходимо затратить некоторую энергию, называемую энергией ионизации. То наименьшее значение напряжения поля, при котором скорость электронов становится достаточной для ионизации атомов, называют потенциалом ионизации атомов данного элемента. 1 эВ=16*10-19 Дж. Для отрыва каждого последующего электрона требуется большая затрата энергии. Чем меньше потенциал ионизации, тем сильнее должны быть выражены металлические свойства элемента. В одной и той же подгруппе периодической системы с увеличением порядкового номера элемента потенциал ионизации уменьшается.
Энергия, выделяющаяся при присоединении электрона к свободному атому называется сродство атома к электрону. Сродство к электрону атома к неметаллу всегда положительно и тем больше, чем ближе к благородному газу распложен неметалл в периодической системе.
Способности атома данного элемента оттягивать к себе электронную плотность в молекуле получило название электроотрицательность. В периодической системе электроотрицательность возрастает в направлении слева на право для элементов каждого периода и уменьшается в направлении сверху вниз ля элементов одной и той же группы.
Орбитальный радиус атома, – радиус электронных облаков внешнего электронного слоя.
5. Окислительно-восстановительные и кислотно-основные свойства элементов и веществ.

Химическая связь и строение молекул.
1. Свойства ковалентной связи и способы ее образования.
Ковалентная связь (КС) – тип связи, который возникает при обобществлении электронов взаимодействующих атомов. Для описания такого вида связи используют метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
МВС (иначе метод локализованных электронных пар) основан на следующих положениях:
1. КС образуется двумя атомами за счет перекрывания двух электронных облаков с антипараллельными спинами;
2. Связь располагается в том направлении, в котором будет обеспечиваться наибольшая область перекрывания АО;
3. КС тем прочнее, чем больше область перекрывания АО.
КС может возникнуть:
1) по обменному механизму за счет объединения одноэлектронных АО по одному со стороны каждого атома:
Число одноэлектронных АО может увеличиваться при переходе атома в возбужденное состояние;
2) по донорно-акцепторному механизму за счет объединения пары электронов одного атома (донора) и свободной АО другого атома (акцептора):
донор акцептор
Основными свойствами КС являются насыщаемость, направленность и полярность. Общее число КС, которое способен образовать атом, ограничено числом его АО (свободных и занятых), использование которых энергетически выгодно. Для элементов первого и второго периодов энергетически выгодно использование АО только внешнего энергетического уровня. Начиная с третьего и далее периодов, кроме s- и p- орбиталей внешнего уровня в образовании КС могут участвовать d- орбитали внешнего и (или) предвнешнего энергетических уровней. Таким образом, максимальное число КС у каждого атома ограничено его валентными возможностями, то есть связь насыщаема.
Для обеспечения наиболее полного перекрывания электронных облаков взаимодействующие атомы вынуждены располагаться в пространстве относительно друг друга определенным образом – направленно. По типу перекрывания (направленности) различают:
1. s -связь – перекрывание АО происходит вдоль оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению только одной области перекрывания. К образованию такого вида связи способны электронные облака любой формы. Например, s р-р перекрывание образуется таким образом:
2. p- связь – перекрывание АО происходит по обе стороны от оси, соединяющей ядра взаимодействующих атомов, что приводит к возникновению двух областей перекрывания. Например,
p р – р перекрывание:
К образованию такого вида связи не способны s -электронные облака;
3. d- связь – перекрывание двух d -орбиталей, находящихся в параллельных плоскостях, с образованием четырех областей перекрывания.
При образовании КС между атомами одинаковой химической природы (например, в молекулах Н2, Cl2, О2) общее электронное облако располагается в пространстве между ядрами симметрично. Такую КС называют неполярной. Если же связь образуют атомы разных элементов, то общие электроны смещаются в сторону атома с большим значением ЭО и такую КС называют полярной.
2. Основные типы гибридизации АО. Теория локализованных электронных пар.
Гибридизацией АО называют процесс смешения нескольких различных по форме и энергии АО данного атома, который сопровождается образованием такого же числа новых, одинаковых по форме и энергии гибридных АО, располагающихся в пространстве относительно друг друга таким образом, чтобы обеспечить более полное перекрывание с АО соседних атомов в частице.
В процессе гибридизации могут участвовать как одноэлектронные АО, так и АО, занятые спаренными электронами. Одноэлектронные гибридные АО способны образовывать связи с другими атомами и определяют тем самым геометрическую форму молекулы или иона, поэтому их называют связывающими. Двухэлектронные гибридные АО обычно не участвуют в образовании связей (исключение – донорно-акцепторный механизм), называются несвязывающими (при записи формулы молекулы их обозначают Ё) и не учитываются при выявлении геометрической формы образовавшейся частицы. В табл. 5 приведены наиболее распространенные виды гибридизаций АО и формы молекул, которые им соответствуют.
МВС (иначе метод локализованных электронных пар) основан на следующих положениях:
1. КС образуется двумя атомами за счет перекрывания двух электронных облаков с антипараллельными спинами;
2. Связь располагается в том направлении, в котором будет обеспечиваться наибольшая область перекрывания АО;
3. КС тем прочнее, чем больше область перекрывания АО.
3. Ионная связь и ее свойства.
Ионная связь: Образуется в результате передачи электронов атомам одного элемента атомам другого.
Свойства ионных соединений:
Поляризацией называют суммарный эффект, получающийся при сочетании поляризующего действия (ПД) ионов с их поляризуемостью. Поляризуемость – это способность электронного облака частицы к деформации под действием электростатического поля другого иона, а напряженность этого поля определяет ПД иона.
4. Металлическая связь и ее свойства.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Свойства:
Наличие свободных электронов (электронного газа) у веществ с металлической связью проводит к тому, что эти вещества обладают высокой электро- и теллопроводностью, имеют металлический блеск, пластичны (их можно ковать, деформировать без разрушения металлической связи). Большинство металлов твёрдые, причём температура плавления напрямую связана с прочностью или особенностями металлической связи.
5. Водородная связь. Силы межмолекулярного взаимодействия.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F.
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
Межмолекулярное взаимодействие имеет электростатическую природу. Предположение о его существовании было впервые использовано Я. Д. Ван-дер-Ваальсом в 1873 году для объяснения свойств реальных газов и жидкостей. В наиболее широком смысле под ним можно понимать такие взаимодействия между любыми частицами (молекулами, атомами, ионами), при которых не происходит образования химических, то есть ионных, ковалентных или металлических связей. На больших расстояниях преобладают силы притяжения, которые могут иметь ориентационную, поляризационную (индукционную) и дисперсионную природу. При усреднении по вращению частиц, происходящему вследствие теплового движения, потенциал межмолекулярных сил обратно пропорционален шестой степени расстояния, а ион-дипольных (как с постоянным, так и с наведенным диполем) — четвёртой степени. На малых расстояниях начинают преобладать силы отталкивания электронных оболочек частиц. Особым случаем является водородная связь — возникающее на малом расстоянии взаимодействие между атомом водорода одной молекулы и электроотрицательным атомом другой, когда эти атомы несут достаточно большой эффективный заряд.
Энергетика химических процессов.
1. Понятия: термодинамическая система, термодинамические параметры, внутренняя энергия, теплота, работа, энтальпия, энтропия.
Термодинамическая система – совокупность тел, мысленно выделенная из пространства, в которой возможен массо- и теплообмен между ее составными частями.
Состояние системы принято характеризовать термодинамическими параметрами (свойствами системы). При изменении хотя бы одного из параметров система переходит из начального состояния № 1 в конечное состояние № 2, т. е. совершает термодинамический процесс. Такие процессы бывают изобарические (протекают при условии постоянства давления, Р = const); изохорические (V = const); изотермические (T = const) и адиабатические (нет теплообмена с окружающей средой, т. е. q = 0).
Любая система обладает определенным запасом энергии, которую называют внутренней энергией U, Дж/моль. Внутренняя энергия включает в себя энергию движения и взаимодействия молекул, атомов, ядер и других частиц, внутриядерную и другие виды энергий, кроме кинетической энергии движения системы как целого и потенциальной энергии ее положения. Количественный учет всех составляющих внутренней энергии невозможен, поэтому пользуются величиной изменения внутренней энергии D U.
Для процессов, протекающих в изолированных системах, т. е. системах, не обменивающихся с окружающей средой ни веществом, ни энергией, выполняется I закон термодинамики: вся сообщенная системе теплота q расходуется на увеличение внутренней энергии системыD U и на совершение работы против внешних сил А.
q = D U + А.
Положительной (А > 0) считается работа, совершаемая системой против внешних сил, а q > 0 в том случае, когда система поглощает тепло извне. Теплоту и работу называют функциями процесса, так как их значения зависят от способа проведения процесса.
Если на систему не действуют никакие другие силы, кроме постоянного внешнего давления, то при протекании химического процесса единственным видом работы является работа расширения А = Р × D V. В этом случае I закон термодинамики передается уравнением
qp = D U + Р × D V = D H,
где qp – теплота изобарического процесса, Дж; D H = H 2 – H 1 – изменение энтальпии, Дж или Дж/моль.
Величина H = U + Р × V называется энтальпией и является ФСС.
Для изохорического процесса работа расширения системы равна нулю, следовательно, I закон термодинамики будет выражаться уравнением
qV = D U,
где qV – теплота изохорического процесса, Дж или Дж/моль.
Для химических реакций D U и D H связаны между собой соотношением
D U = D H – D n× R× T,
где D n – изменение числа моль газообразных веществ в реакции, моль; T – температура, К; R = 8,314  – универсальная газовая постоянная.
– универсальная газовая постоянная.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 579; Нарушение авторских прав?; Мы поможем в написании вашей работы!