
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Где [Ktz+], [Аnz–], [(Kt)x(Аn)y] – равновесные концентрации катиона, аниона и недиссоциированных молекул, моль/дм3
|
|
|
|
Для слабых электролитов процесс диссоциации является обратимым и характеризуется константой равновесия, которая называется константой диссоциации КД (иначе константой ионизации). KД характеризует способность электролита распадаться на ионы: чем меньше константа диссоциации, тем слабее электролит и тем в меньшей степени его молекулы диссоциированы на ионы. Она не зависит от концентраций электролита и ионов, а зависит от природы электролита и температуры. Значения констант диссоциации для большинства электролитов содержаться в справочниках.
Для электролита, распадающегося на ионы по схеме
(Kt) х (Аn) у Û x× Kt z+ + y× Аn z–
выражение для константы диссоциации имеет вид
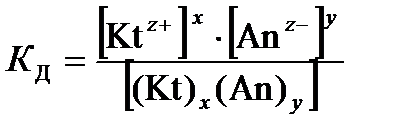 , (22)
, (22)
Для бинарного электролита, то есть для электролита, дающего при диссоциации одной молекулы два иона по уравнению
KtАn Û Kt z+ + Аn z–
между K Ди aсуществует количественная зависимость (закон разбавления Оствальда)
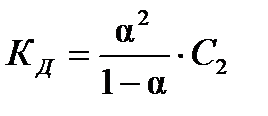 . (23)
. (23)
Для растворов очень слабых электролитов a<< 1 и (1 – a)» 1, тогда формула (23) примет вид
K Д = a2 × С 2 . (24)
Отсюда a = 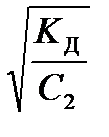 . (25)
. (25)
Для слабых электролитов, для которых из одной молекулы образуется более двух ионов, процесс диссоциации протекает ступенчато. Например, для ортофосфорной кислоты:
Н3РО4 Û Н+ + Н2РО  , K Д 1 = 7,1×10–3, a1 = 27 % – для I ступени;
, K Д 1 = 7,1×10–3, a1 = 27 % – для I ступени;
Н2РО  Û Н+ + НРО
Û Н+ + НРО 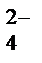 , K Д 2 = 6,2×10–8, a2 = 0,15 % – для II ступени;
, K Д 2 = 6,2×10–8, a2 = 0,15 % – для II ступени;
НРО 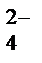 Û Н+ + РО
Û Н+ + РО  , K Д 3 = 5,0×10–13, a3 = 0,005 % – для III ступени.
, K Д 3 = 5,0×10–13, a3 = 0,005 % – для III ступени.
Константа диссоциации суммарного процесса равна произведению констант диссоциации по всем ступеням:
Н3РО4 Û 3Н+ + РО  , K Д = K Д 1 × K Д 2 × K Д 3 = 2,2 × 10–22.
, K Д = K Д 1 × K Д 2 × K Д 3 = 2,2 × 10–22.
7. Произведение растворимости.
Для любого труднорастворимого электролита (Kt) х (Аn) у между его осадком и насыщенным раствором устанавливается равновесие вида
(Kt) х (Аn) у Û x× Kt z+ + y× Аn z–.
осадок насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 395; Нарушение авторских прав?; Мы поможем в написании вашей работы!