
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопросы к экзамену и зачету 2 страница
|
|
|
|
2. Основы термохимии: закон Гесса и его следствия.
Основным законом термохимии является закон Гесса: тепловой эффект химической реакции не зависит от пути ее протекания, т. е. числа и характера промежуточных стадий, а зависит только от природы и состояния исходных веществ и продуктов реакции.
Поясним закон Гесса на примере образования СО2, который может быть получен двумя способами:
I способ: С + О2 = СО2 + Q 1;
II способ: 1) С +  О2 = СО + Q 2; 2) СО +
О2 = СО + Q 2; 2) СО + 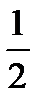 О2 = СО2 + Q 3.
О2 = СО2 + Q 3.
Согласно закону Гесса, тепловые эффекты образования СО2 по I и II способам должны быть равны, т. е. Q 1 = Q 2 + Q 3.
Из закона Гесса вытекает несколько важных следствий.
Следствие 1 (иначе закон Лавуазье – Лапласа). Теплота, выделяющаяся при образовании вещества, равна теплоте, поглощаемой при разложении такого же его количества на исходные составные части. Это означает, что, например, для реакций
СаСО3, т = СаОт + СО2, г, D Н 1;
СаОт + СО2, г = СаСО3, т, D Н 2
при T = constбудет выполняться соотношение D Н 1 = –D Н 2.
Следствие 2. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Для реакции общего вида a A + b B = d D + f F данное следствие имеет вид
D Н = d D Н  (D) + f D Н
(D) + f D Н  (F) – a D Н
(F) – a D Н  (A) – b D Н
(A) – b D Н  (B),
(B),
где D Н  – энтальпия образования вещества, т. е. D Н реакции образования 1 моль данного вещества из простых веществ, Дж/моль.
– энтальпия образования вещества, т. е. D Н реакции образования 1 моль данного вещества из простых веществ, Дж/моль.
Если D Н  вещества определена при стандартных условиях, то ее называют стандартной энтальпией образования вещества и обозначают D Н
вещества определена при стандартных условиях, то ее называют стандартной энтальпией образования вещества и обозначают D Н 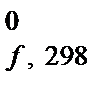 . Для большинства химических соединений значения D Н
. Для большинства химических соединений значения D Н 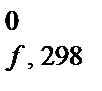 приведены в справочной литературе, а значения D Н
приведены в справочной литературе, а значения D Н 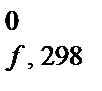 простых веществ, устойчивых при стандартных условиях, приняты равными нулю.
простых веществ, устойчивых при стандартных условиях, приняты равными нулю.
Следствие 3. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ минус сумма энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Или математически для реакции вида a A + b B = d D + f F
D Н = a D Н  (A) + b D Н
(A) + b D Н 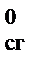 (B) – d D Н
(B) – d D Н 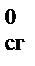 (D) – f D Н
(D) – f D Н 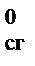 (F),
(F),
где D Н  – энтальпия сгорания вещества, т. е. D Н реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов, Дж/моль.
– энтальпия сгорания вещества, т. е. D Н реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов, Дж/моль.
3. Тепловые эффекты процессов, термохимические уравнения.
Тепловым эффектом химической реакции Q называют количество теплоты, которое поглощается или выделяется при полном необратимом протекании реакции в изобарно-изотермических или изохорно-изотермических условиях. Если в результате реакции теплота выделяется во внешнюю среду, то Q считается положительным, а реакцию называют экзотермической. При протекании процесса с поглощением теплоты реакцию называют эндотермической, а Q < 0. Согласно принятой системе знаков,
Q = – q.
Тепловой эффект реакции, определенный в условиях Р, Т = const, обозначается QP, а в изохорно-изотермических – QV. Из I закона термодинамики следует:
QV = – qV = – D U; QP = – qp = – D H.
Уравнение химической реакции, записанное с указанием его теплового эффекта, называется термохимическим уравнением. В таких уравнениях необходимо указывать фазовое состояние веществ (например: г – газовое, ж – жидкое, к – кристаллическое, т – твердое, р – растворенное и др.), кроме очевидных случаев; допускается введение дробных коэффициентов перед веществами; имеется возможность производить с уравнениями некоторые алгебраические операции (сложение, вычитание, деление или умножение на целое число).
В термохимических уравнениях тепловой эффект принято записывать либо непосредственно в уравнении реакции, например:
Н2, г +  О2, г = Н2Ож + QP, кДж,
О2, г = Н2Ож + QP, кДж,
либо после уравнения, например:
Н2, г +  О2, г = Н2Ож, D Н = – QP,
О2, г = Н2Ож, D Н = – QP,  .
.
Последняя форма записи употребляется чаще.
Тепловые эффекты различных процессов определяют при одинаковых условиях: давление равно 101 325 Па (1 атм), температура составляет 298 К. Такие условия называются стандартными, а соответствующий им тепловой эффект – стандартным тепловым эффектом, который обозначают D H 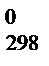 (или D U
(или D U  ).
).
4. Энтропия и ее изменение при химических реакциях.
Большинство процессов представляют собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга. Мерой неупорядоченности среди частиц в системе служит ФСС, называемая энтропией S, 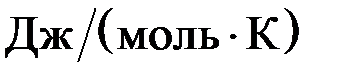 . В отличие от других ФСС, можно определить не только изменение энтропии D S, но и абсолютное значение энтропии. Для большинства веществ абсолютные энтропии в стандартных условиях S
. В отличие от других ФСС, можно определить не только изменение энтропии D S, но и абсолютное значение энтропии. Для большинства веществ абсолютные энтропии в стандартных условиях S 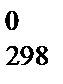 определены и приведены в справочниках.
определены и приведены в справочниках.
При переходе вещества из твердого состояния в жидкое и далее в газообразное значительно снижается упорядоченность частиц, поэтому S газа >> S ж > S тв .
При одинаковом агрегатном состоянии энтропия вещества тем выше, чем больше атомов содержится в молекуле. Например, энтропии газообразных О, О2 и О3 равны соответственно 161, 205 и
239 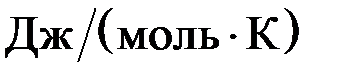 .
.
Переход вещества из одного агрегатного состояния в другое сопровождается изменением энтропии D S фп, которое можно оценить по формуле, Дж/К:
 ,
,
где  – тепловой эффект, которым сопровождается данный фазовый переход, Дж/моль;
– тепловой эффект, которым сопровождается данный фазовый переход, Дж/моль;  – температура фазового перехода, К; n – количество вещества, моль.
– температура фазового перехода, К; n – количество вещества, моль.
Расчет D S 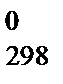 химической реакции осуществляют по формуле
химической реакции осуществляют по формуле
D S  = d S
= d S 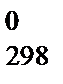 (D) + f S
(D) + f S  (F) – a S
(F) – a S  (A) – b S
(A) – b S  (B).
(B).
Качественно об изменении энтропии можно судить по изменению объема системы в ходе реакции. Если объем системы увеличивается, то D S  > 0, а если реакция протекает с уменьшением объема, то D S
> 0, а если реакция протекает с уменьшением объема, то D S 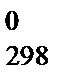 < 0.
< 0.
5. Энергия Гиббса. Критерии определения реакционной способности
Совместное влияние энтальпийного и энтропийного факторов учитывает изменение энергии Гиббса D G, кДж/моль: D G = D Н – T× D S.
Самопроизвольно при Р, Т = const в прямом направлении могут протекать реакции, для которых D G < 0. Если для реакции D G > 0, то такой процесс может протекать самопроизвольно только в обратном направлении, а реакции, имеющие D G = 0, находятся в состоянии равновесия, т. е. для них термодинамическая вероятность прямого и обратного течения процесса одинакова.
Расчет изменения энергии Гиббса в стандартных условиях D G  для реакции вида a A + b B = d D + f F можно осуществить либо по уравнению
для реакции вида a A + b B = d D + f F можно осуществить либо по уравнению
D G  = D Н
= D Н 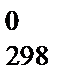 – Т× D S
– Т× D S  ,
,
либо по формуле
D G  = d D G
= d D G 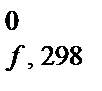 (D) + f D G
(D) + f D G 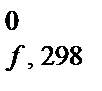 (F) – a D G
(F) – a D G 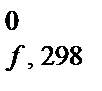 (A) – b D G
(A) – b D G 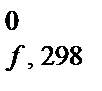 (B),
(B),
где D G 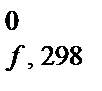 – стандартная энергия Гиббса образования вещества, кДж/моль.
– стандартная энергия Гиббса образования вещества, кДж/моль.
Значения D G 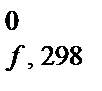 для простых веществ равны нулю, а для сложных – содержатся в справочной литературе.
для простых веществ равны нулю, а для сложных – содержатся в справочной литературе.
Химическая кинетика и химическое равновесие.
1. Закон действия масс для химических систем, константа химического равновесия.
Закона действующих масс для химического равновесия:при постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Если все участники реакции являются газообразными веществами, то вместо равновесных концентраций удобнее пользоваться равновесными парциальными давлениями компонентов РА, РВ, РD и РM, тогда закон действующих масс пример вид
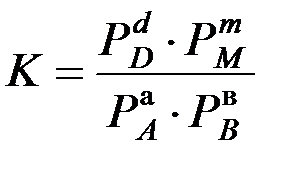 .
.
Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Например, для гетерогенной реакции: Сграфит + 2Н2Огаз «СО2, газ + 2Н2, газ
константа равновесия выражается уравнением
 .
.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Влияние температуры на K определяется знаком теплового эффекта реакции. Для эндотермической реакции (D Н > 0) при повышении Т константа равновесия увеличивается. И наоборот, для экзотермической реакции (D Н < 0) при возрастании температуры значения K уменьшается.
2. Принцип Ле Шателье.
При изменении условий проведения реакции смещение химического равновесия в сторону прямой или обратной реакции происходит в соответствии с принципом Ле Шателье: если в равновесной смеси изменить концентрацию одного из реагирующих веществ, температуру или давление, то равновесие смещается в направлении той реакции (прямой или обратной), которая ослабляет эффект от данного воздействия на равновесную систему.
3. Основной закон химической кинетики. Константа скорости реакции.
Зависимость скорости реакции от концентраций реагентов устанавливает основной закон химической кинетики: при постоянной температуре мгновенная скорость реакции u прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях частных порядков реакции.
Математическая запись закона для гомогенной реакции общего вида (иначе кинетическое уравнение реакции) будет отражаться уравнением: u = k × [ А ]  × [ В ]
× [ В ]  ,
,
где k – константа скорости реакции; [ А ], [ В ] – концентрации реагентов, моль/дм3; nА, nВ – порядок реакции соответственно по веществу А и по веществу В.
4. Кинетическая классификация реакций.


5. Влияние температуры на скорость реакции: температурный коэффициент, энергия активации.
Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на 10 К скорость большинства реакций увеличивается в 2¸4 раза:
u2 = u1×  ,
,
где u1, u2 – скорости реакции при температурах Т 1 и Т 2; g – температурный коэффициент Вант-Гоффа, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 К.
Для многих реакций в интервале температур от комнатных значений до 400 °С температурный коэффициент лежит в пределах от 2 до 4. Более точно значение g можно вычислить по формуле
 ,
,
где k 1, k 2 – константы скорости реакции при температурах Т 1 и Т 2.
Более строгая зависимость скорости реакции от температуры описывается уравнением Аррениуса
k = k 0 ×  ,
,
где k – константа скорости реакции при температуре Т; k 0 – предэкспоненциальный множитель; е – основание натурального логарифма; ЕА – энергия активации, Дж/моль.
Энергией активации называют избыток энергии, которым должны обладать молекулы, по сравнению со средним значением энергии частиц в системе, чтобы их столкновение привело к образованию продуктов реакции. Значение энергии активации зависит от природы реагирующих веществ. Для химических реакций значения Е А лежат в пределах 40¸400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по формуле
Е А = 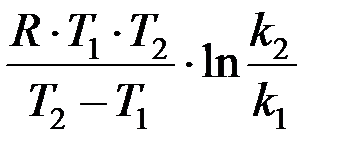 .
.
6. Катализаторы, каталитические системы.
Катализатор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
По своим физическим свойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы — это твердые вещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества.
Каталитическая система открытая, так как условием её существования является непрерывный обмен веществ и энергией с окружающей средой.
Деструктивный процесс, поступающих извне веществ, осуществляемый системой, поддерживает ее организацию и способствует ее изменениям.
Растворы. Дисперсные системы.
1. Способы выражения состава растворов.
Состав раствора принято выражать с помощью следующих величин:
1. Массовая доля растворенного вещества w2 (иначе процентная массовая концентрация) – отношение массы растворенного вещества m 2 к массе раствора m
 (1)
(1)
Здесь и далее у величин, относящихся к растворителю, применяется индекс «1», индекс «2» относится к растворенному веществу, а отсутствие индекса указывает на свойство раствора как целого.
2. Моляльная концентрация вещества Сm (иначе моляльность раствора) – отношение числа моль растворенного вещества n 2 к массе растворителя m 1 в килограммах
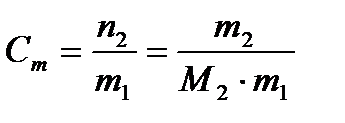 , (2)
, (2)
где М 2 – молярная масса растворенного вещества, г/моль.
Если массу растворителя выражать в граммах, то для расчета моляльности следует пользоваться формулой
 . (3)
. (3)
3. Молярная концентрация вещества С 2 (иначе молярность раствора) – отношение числа моль растворенного вещества к объёму раствора V в дм3 (иначе в литрах)
 . (4)
. (4)
Она показывает, сколько моль растворенного вещества содержится в 1 дм3 раствора. Единицы измерения – моль/дм3 или М.
4. Молярная концентрация эквивалента вещества С 2 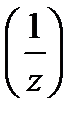 (иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2
(иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2 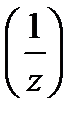 к объёму раствора в дм3
к объёму раствора в дм3
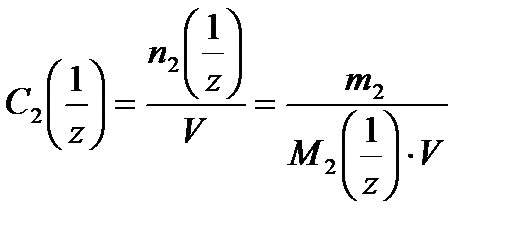 , (5)
, (5)
где М 2  – молярная масса эквивалента растворенного вещества, г/моль; z – число эквивалентности растворенного вещества.
– молярная масса эквивалента растворенного вещества, г/моль; z – число эквивалентности растворенного вещества.
Взаимосвязь между молярной и нормальной концентрациями одного и того же растворенного вещества выражается соотношением
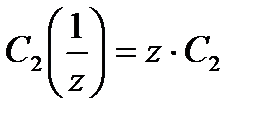 . (6)
. (6)
5. Титр раствора Т – масса растворенного вещества в граммах, которая содержится в одном см3 (иначе 1 мл) раствора
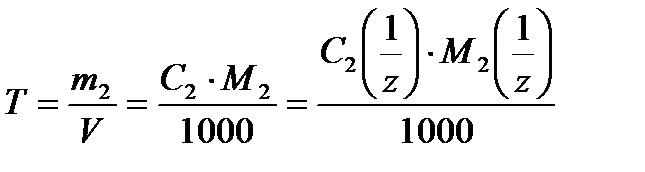 . (7)
. (7)
Единицы измерения данного способа выражения состава раствора –г/мл или г/см3.
6. Мольная доля растворенного вещества х 2 – отношение числа моль растворенного вещества к общему числу моль всех компонентов раствора n
 . (8)
. (8)
Это безразмерная величина, выраженная в долях единицы.
2. Закон Рауля для бесконечно разбавленного раствора неэлектролита.
Понижение давления пара (первый закон Рауля).
Относительное понижение давления насыщенного пара растворителя при образовании раствора равно мольной доле растворенного вещества. Или математически
 =
=  , (13)
, (13)
где Р – давление насыщенного пара над раствором; Р 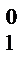 – давление насыщенного пара чистого растворителя; х 2 – мольная доля растворенного вещества.
– давление насыщенного пара чистого растворителя; х 2 – мольная доля растворенного вещества.
Повышение температуры кипения раствора (второй закон Рауля).
Повышение температуры кипения раствора D T кип прямо пропорционально моляльной концентрации растворенного вещества.
D T кип= T кип – Т  = К Э × Сm, (14)
= К Э × Сm, (14)
где К Э – эбуллиоскопическая константа, 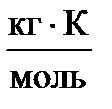 ; Сm - моляльная концентрация, моль/кг; Т
; Сm - моляльная концентрация, моль/кг; Т 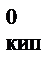 - температура кипения чистого растворителя, К или °С; T кип – температура кипения раствора, К или °С.
- температура кипения чистого растворителя, К или °С; T кип – температура кипения раствора, К или °С.
Понижение температуры замерзания (кристаллизации) раствора.
Понижение температуры замерзания раствора D T зам прямо пропорционально моляльной концентрации растворенного вещества.
D T зам = Т  – T зам = К К × Сm, (15)
– T зам = К К × Сm, (15)
где К К – криоскопическая константа, 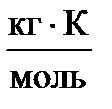 ; Т
; Т  - температура замерзания чистого растворителя, К или °С; T зам – температура замерзания раствора, К или °С.
- температура замерзания чистого растворителя, К или °С; T зам – температура замерзания раствора, К или °С.
Таким образом, раствор кипит при более высокой температуре, чем чистый растворитель, а замерзает при более низкой температуре. Значение эбуллиоскопическойи криоскопической константы зависит только от природы растворителя и приведено в справочной литературе.
По повышению температуры кипения или понижению температуры замерзания раствора можно вычислить молярную массу растворенного вещества
M 2 = К Э×  . (16)
. (16)
M 2 = K К×  . (17)
. (17)
3. Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
Осмос — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества (меньшей концентрации растворителя).
Давление, которое нужно приложить к раствору, чтобы остановить одностороннюю диффузию растворителя через полупроницаемую перегородку, называют осмотическим (Р осм). Закон Вант-Гоффа гласит, что осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора
Р осм = С 2 × R × T, (18)
где P осм – осмотическое давление, кПа; С 2 – молярная концентрация вещества, моль/дм3; R = 8,314 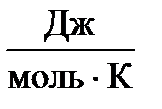 – универсальная газовая постоянная; Т – абсолютная температура, К.
– универсальная газовая постоянная; Т – абсолютная температура, К.
4. Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
Рауль доказал, что повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбулиоскопическая и криоскопическая константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
5. Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
Электролитами называют вещества, которые в растворе или расплаве полностью или частично распадаются на ионы.Сила электролита определяется степенью диссоциации a, которая равнаотношению числа молекул, распавшихся на ионы N, к общему числу растворенных молекул N общ,доли единицы или %
a =  ×100 %. (19)
×100 %. (19)
По величине степени диссоциации электролиты делят на сильные (a > 0,3)и слабые (a < 30 %).
Расчет концентраций ионов для слабого электролита следует вести по формуле
[ион] = n × a × C 2 , (20)
где n – число ионов данного сорта, образующихся при диссоциации одной молекулы.
Для сильного электролита степень диссоциации практически равна 1 и формула (20) принимает вид
[ион] = n × C 2 . (21)
Изотонический коэффициент i показывает, во сколько раз экспериментально найденное свойство раствора электролита отличается от такого же свойства, вычисленного для раствора неэлектролита при той же концентрации:
i = 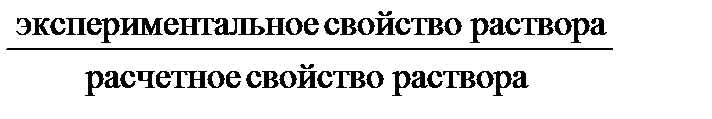 ,
,
где «свойство раствора» – Р осм, D Р, D Т кип или D Т зам.
Коллигативные свойства для разбавленных растворов электролитов следует оценивать с учетом изотонического коэффициента по формулам
 =
= 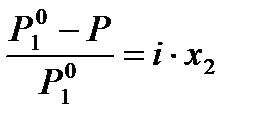 , (34)
, (34)
D T кип= T кип – Т  = i× К Э × Сm, (35)
= i× К Э × Сm, (35)
D T зам = Т  – T зам = i× К К × Сm, (36)
– T зам = i× К К × Сm, (36)
Р осм = i× С 2 × R × T, (37)
6. Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 622; Нарушение авторских прав?; Мы поможем в написании вашей работы!