
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выражение для произведения растворимости имеет вид
|
|
|
|
ПР =  (g + ·[Kt z+ ]) x × (g– ·[Аn z– ]) y, (46)
(g + ·[Kt z+ ]) x × (g– ·[Аn z– ]) y, (46)
где а +, а – – активности катиона и аниона; g + , g– – коэффициенты активностей катиона и аниона; [Kt z+ ], [Аn z– ] – равновесные молярные концентрации ионов, моль/дм3.
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (46) примет вид
ПР = [ Kt z+ ] x × [Аn z– ] y. (47)
ПР электролита при данной температуре есть величина постоянная. Численные значения произведения растворимости большинства труднорастворимых электролитов приведены в справочной литературе.
По величине ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Если произведение концентраций ионов (ПРрасч) в каком-либо растворе соли больше, чем табличное значение ПРтабл, то в растворе будет присутствовать осадок данного вещества. И наоборот, если ПРрасч < ПРтабл, то осадок данного вещества растворится.
Равновесные молярные концентрации ионов [Kt z+ ] и [Аn z– ] пропорциональны растворимости вещества L (моль/дм3)
[Kt z+ ] = x × L; [Аn z– ] = y× L. (48)
Отсюда ПР[(Kt) х (Аn) у ] = (x×L) x × (y× L) y;(49)
L = 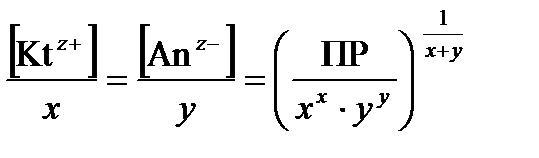 . (50)
. (50)
8. Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель рН, гидроксильный показатель рОН.
Ионным произведением воды K В называют произведение активности (или концентрации) ионов водорода на активность (или концентрацию) гидроксид-ионов
K В = а  × а
× а  = [Н +]×[ОН – ]. (38)
= [Н +]×[ОН – ]. (38)
K В характеризует равновесие процесса диссоциации воды по схеме Н2О = Н + + ОН –. Ионное произведение воды является постоянной величиной и зависит только от температуры раствора. Если раствор имеет комнатную температуру, то при расчетах K Впринимают равной 1×10–14.
Концентрации Н + и ОН – принято выражать в логарифмических единицах, в виде так называемых водородного показателя рНи гидроксильного показателя рОН
рН = – lg а 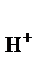 = –lg[Н+], (39)
= –lg[Н+], (39)
рОН = – lg а 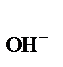 = – lg[ОН–], (40)
= – lg[ОН–], (40)
Из уравнения (38) с учетом формул (39) и (40) следует, что
рН + рОН = 14. (41)
По значению рН растворы принято делить на три группы:
1) кислые –рН < 7; 2) щелочные – рН > 7; 3) нейтральныео – рН = 7.
Растворы, содержащие слабый электролит и его соль, способны поддерживать постоянным значение рН раствора. Такие растворы называют буферными. Их можно разделить на два типа: кислотный буфер – состоит из слабой кислоты и её соли; основной буфер – состоит из слабого основания и его соли.
Расчет концентрации ионов Н + в кислотном буфере следует вести по формуле
[Н+] =  , (42)
, (42)
где К Д(кислоты) – константа диссоциации слабой кислоты; [кислоты], [соли] – молярные концентрации кислоты и ее соли, моль/дм3.
Из формулы (42) следует, что
рН = р K Д(кислоты) – lg  , (43)
, (43)
где р К Д(кислоты) = –lg К Д(кислоты).
По аналогии для буферной смеси слабого основания и его соли
рН = 14 – р K Д(основания) + lg 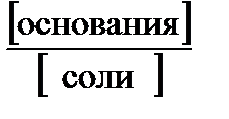 , (44)
, (44)
где р K Д(основания) = -lg K Д(основания).
Способность буферного раствора поддерживать постоянное значение рН определяется его буферной ёмкостью В, которая характеризуется количеством моль сильной кислоты или сильного основания, которое требуется ввести в 1 дм3 буферного раствора, чтобы изменить его рН на единицу. Буферная ёмкость выражается в моль/дм3 и определяется по формуле
 , (45)
, (45)
где С 2 – молярная концентрация сильной кислоты или основания; V – объём добавленного сильного электролита; VВ – объём буферного раствора; ΔpH – величина изменения рН раствора.
Добавление к буферному раствору кислоты понижает рН раствора, а прибавление щелочи увеличивает рН раствора. Буферная ёмкость раствора тем больше, чем выше концентрация его компонентов.
9. Ионные реакции, смещение ионного равновесия.


10. Гидролиз солей. Константа и степень гидролиза.
Гидролизом соли называетсявзаимодействие ионов соли с молекулами воды, сопровождающееся изменением рН раствора. Гидролиз протекает только тогда, когда при взаимодействии ионов и воды образуются малодиссоциированные вещества. Известны следующие виды гидролиза солей.
1. Гидролиз по аниону.
В этом случае гидролизуются соли сильного основания и слабой кислоты, при этом реакция среды становится щелочной (рН > 7). Например
СН3СООNa ® СН3СОО – + Na+;
Na+ + HOH®реакция практически не идет;
СН3СОО – + HOH Û СН3СООН + ОН –,рН > 7.
Молекулярное уравнение гидролиза
СН3СООNa + HOH Û СН3СООН + NaОН.
Если анион многозарядный, то гидролиз протекает ступенчато, например
Na2CO3 + HOH Û NaHCO3 + NaOH;
I ступень гидролиза: CO 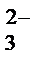 + HOH Û HCO
+ HOH Û HCO 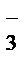 + OH –;
+ OH –;
II ступень гидролиза: НCO 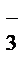 + HOH Û H2CO3 + NaOH.
+ HOH Û H2CO3 + NaOH.
Накапливающиеся в растворе ионы ОН –препятствуют протеканию II ступени гидролиза, поэтому практически гидролиз идет только по I ступени.
2.Гидролиз по катиону.
В этом случае гидролизуются соли слабого основания и сильной кислоты, при этом реакция среды становится кислой (рН < 7). Например
(NH4)2SO4 ® 2NH4+ + SO 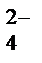 ;
;
SO  + HOH ® реакция практически не идет;
+ HOH ® реакция практически не идет;
NH4+ + HOH Û NH4OH + H+, рН < 7.
Молекулярное уравнение гидролиза
(NH4)2SO4 + HOH Û NH4OH + NH4HSO4 .
Гидролиз не доходит до конца, так как накопление в растворе ионов водорода препятствует образованию свободной кислоты.
3. Гидролиз по катиону и аниону одновременно.
Такому виду гидролиза подвергаются соли слабого основания и слабой кислоты. В реакции участвуют и катион, и анион соли. Реакция среды определяется относительной силой образующихся слабой кислоты и слабого основания. Если K Д (кислоты) > K Д (основания), то рН < 7; если K Д (кислоты)) < K Д (основания), то рН > 7, а когда K Д (кислоты) = K Д (основания), то рН» 7. Например
NH4COOH + HOH Û NH4OH + HCOOH, рН = 7,
так как K Д(HCOOH) = K Д(NH4OH) = 1,76 × 10-5.
4. Необратимый полный гидролиз.
Если кислота и основание, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, то гидролиз, как правило, протекает практически необратимо, например Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S ;
2Al3+ + 3S2– + 6HOH ® 2Al(OH)3¯ + 3H2S .
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза K г.
Степень гидролиза h показывает,какая часть соли находится в гидролизованном состоянии и выражается в долях единицы или в процентах
h = С г/ С 2, (51)
где С г – концентрация гидролизованной части соли; С 2– общая концентрация растворенной соли.
Расчет константы гидролиза K г и степени гидролиза h следует вести по формулам:
1) гидролиз по аниону
K г = 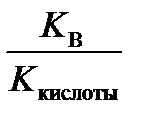 , h =
, h = 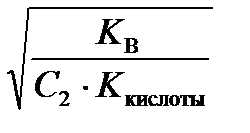 =
= 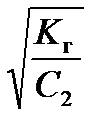 , (52)
, (52)
где K кислоты – константа диссоциации слабой кислоты.
Если гидролиз протекает ступенчато, то в выражение для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.
Концентрация ионов ОН– и рН раствора соли могут быть вычислены по формулам
[ОН–] = 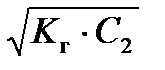 = h× С 2 , (53)
= h× С 2 , (53)
рН = 14 – рОН = 14 + lg  . (54)
. (54)
2) гидролиз по катиону
K г = 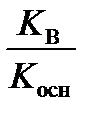 , h =
, h =  =
= 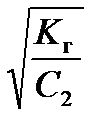 , (55)
, (55)
где K осн – константа диссоциации слабого основания.
[H+] =  = h × С 2 , (56)
= h × С 2 , (56)
рН = –lg[H+] = –lg 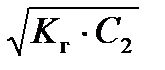 . (57)
. (57)
3 ) гидролиз по катиону и аниону одновременно:
K г =  . (58)
. (58)
Для этого случая концентрация раствора соли практически не влияет на степень гидролиза
h = 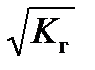 . (59)
. (59)
[H+] = 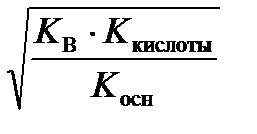 , (60)
, (60)
рН = –lg  . (61)
. (61)
11. Общие понятия о дисперсных системах.
Все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой, и прерывистой фазы (частиц), называемой дисперснойфазой. В зависимости от размера частиц дисперсные системы подразделяют на группы:
а)взвеси (суспензии, эмульсии), у которых частицы имеют размер
1000нм (10 -'6 м) и более;
б)коллоидные системы, размер частиц которых лежит в пределах
от 1 до 500 нм (10 -9 м … 5 ∙ 10 - 7 м).
Дисперсные системы также классифицируются по агрегатным состояниям дисперсной фазы и дисперсионной среды.
Таблица 12.1 - Типы дисперсных систем
| Тип дискретной системы | Фазовое состояние | Примеры | |
| Дисперсионной среды | Дисперсной фазы | ||
| Аэрозоль | Газ | Жидкая | Туман, облака |
| Аэрозоль | Газ | Твердая | Дым, пыль |
| Пена | Жидкая | Газ | Взбитые сливки, мыльная пыль |
| Эмульсия | Жидкая | Жидкая | Молоко, Майонез |
| Золь | Жидкая | Твердая | Краски |
| Твердая эмульсия | Твердая | Жидкая | Масло |
| Гель | Твердая | Жидкая | Железо, Агар-агар |
Характерной особенностью коллоидных частиц является наличие на их поверхности заряда, обусловленного избирательной адсорбцией ионов. Коллоидная частица имеет сложное строение. Она включает в себя ядро, адсорбированные ионы, противоионы и растворитель. Существуют лиофильные (гидрофильные) коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные(гидрофобные) коллоиды, в которых растворитель не взаимодействует с ядром частиц. Растворитель входит в состав гидрофобных частиц лишь как сольватная оболочка адсорбированных ионов или при наличии стабилизаторов (ПАВ), имеющих лиофобную и лиофильные части.
Несколько примеров коллоидных частиц:

|
12. Коллоидные растворы и методы их получения.
Методы получения коллоидных растворов
Коллоидные растворы могут быть получены:
1. Дисперсионными методами, основанными на дроблении, или диспергировании крупных частиц вещества до коллоидных размеров. Диспергирование можно проводить механическим измельчением, электрическим распылением и так далее.
К дисперсным методам относятся – процесс образования золей из гелей или рыхлых осадков при действии на них пептизаторов (в большинстве случаев электролитов), адсорбирующихся на поверхности коллоидных ядер и способствующих их взаимодействию с дисперсионной средой.
2. Конденсационными методами, основанными на агрегации молекул или ионов более крупные частицы. Агрегацию частиц можно осуществлять различными способами. Так, для получения золей гидроксидов металлов чаще всего пользуются методом гидролиза. Например, золь гидроксида железа (III) легко образуется, когда раствор хлорида железа (III) приливают в кипящую воду. Объясняется это тем, что холодный раствор  содержит слабо диссоциированные продукты неполного гидролиза трехвалентного железа
содержит слабо диссоциированные продукты неполного гидролиза трехвалентного железа 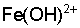 ,
,  , которые при разбавлении в кипящей воде гидролизируются полностью с образованием гидроксида железа (III).
, которые при разбавлении в кипящей воде гидролизируются полностью с образованием гидроксида железа (III).
При конденсационном методе рост частиц прекращается задолго до образования термординамически устойчивой поверхности раздела. Поэтому коллоидные системы, независимо от способа получения, являются термодинамически неустойчивыми. Со временем, в результате стремления к термодинамически более выгодному состоянию, коллоидные системы прекращают существование вследствии коагуляции – процесса укрупнения частиц.
13. Оптические и электрические свойства коллоидных растворов.
Оптические свойства. Если рассматривать путь светового луча, проходящего через совершенно прозрачный коллоидный раствор, сбоку на темном фоне, то он становится видимым. Этот оптический эффект называется конусом Тиндаля (рис.). Он вызывается рассеянием света частицами дисперсной фазы коллоидного раствора и является следствием коллоидной степени дисперсности этих частиц. При сильном увеличении каждая частица в конусе Тиндаля кажется светящейся точкой. Размеры и форму частиц нельзя установить, можно лишь подсчитать их число.
 Частицы дисперсной фазы золей по своим размерам меньше длин волн лучей видимого света. Поэтому они рассеивают свет, причем довольно интенсивно, но не отражают его. Частицы в грубодисперсных системах отражают свет, их величину и форму часто можно установить без оптического увеличения. (Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное и накуренное помещение.)
Частицы дисперсной фазы золей по своим размерам меньше длин волн лучей видимого света. Поэтому они рассеивают свет, причем довольно интенсивно, но не отражают его. Частицы в грубодисперсных системах отражают свет, их величину и форму часто можно установить без оптического увеличения. (Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное и накуренное помещение.)
Электрические свойства. В 1909 г.проф. Московского университета Ф.Рейсе наблюдал воздействие постоянного электрического тока на диспергированную в воде глину и на этом основании описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы же дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости. Направленное движение частиц к электродам говорило об их заряде, причем стало ясным, что дисперсная фаза несет на себе заряд, противоположный по знаку заряду среды. Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного электрического тока получило название электрофореза, а движение частиц дисперсионной среды -электроосмос.
Итак, электрофорез и электроосмос обусловлены наличием разноименного заряда у частиц дисперсной фазы и дисперсионной среды. На границе раздела фаз возникает двойной электрический слой, состоящий из тонкой (адсорбционной) части и протяженной диффузной части. Между фазами возникает разность потенциалов, называемая электротермодинамическим потенциалом. Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим или L -потенциалом. Электрокинетический потенциал определяется толщиной и зарядом диффузного слоя, которые зависят от концентрации и заряда противоионов и температуры. Его значение можно регулировать, например, введением противоионов с высоким значением зарядов.
14. Коагуляция, седиментация и пептизация.
Коагуляция -слипание частиц коллоидной системы при их столкновениях в процессе теплового (броуновского) движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты — более крупные (вторичные) частицы, состоящие из скопления более мелких (первичных). Первичные частицы в таких скоплениях соединены силами межмолекулярного взаимодействия непосредственно или через прослойку окружающей (дисперсионной) среды. Коагуляция сопровождается прогрессирующим укрупнением частиц (увеличением размера и массы агрегатов) и уменьшением их числа в объёме дисперсионной среды — жидкости или газа. Седиментация - оседание или всплывание частиц дисперсной фазы (твёрдых крупинок, капелек жидкости, пузырьков газа) в жидкой или газообразной дисперсионной среде в гравитационном поле или поле центробежных сил. Седиментация происходит, если направленное движение частиц под действием силы тяжести или центробежной силы преобладает над хаотическим тепловым движением частиц. Скорость седиментации зависит от массы, размера и формы частиц, вязкости и плотности среды, а также ускорения, возникающего при действии на частицы сил поля. Для мелких не взаимодействующих между собой сферических частиц скорость седиментации определяется по Стокса формуле. Седиментация в природе приводит к образованию осадочных горных пород, осветлению воды в водоёмах, освобождению атмосферы от находящихся в ней капельножидких и твёрдых частиц.
В производственной практике седиментацию используют для разделения порошков на фракции, выделения в виде осадка различных продуктов химической технологии.
Пептизация, самопроизвольный распад агрегатов (комочков, хлопьев, сгустков), образованных скоплением слипшихся коллоидных частиц, на агрегаты меньших размеров или отдельные первичные частицы. Особенно наглядна пептизация студенистых осадков (коагелей), возникающих вследствие коагуляции золей и высокодисперсных суспензий. При пептизации происходит «коллоидное растворение» осадка — из коагулята вновь образуется золь. Наиболее характерна пептизация при введении в дисперсионную среду пептизаторов — веществ, способствующих дезагрегированию, то есть разъединению слипшихся частиц. Пептизаторами могут быть электролиты и поверхностно-активные вещества, вызывающие лиофилизацию поверхности частиц дисперсной фазы. Так, пептизация геля гидроокиси железа в водной среде возможна при добавлении небольших количеств хлорного железа, а каолин пептизируется гуминовыми кислотами. Перемешивание обычно ускоряет пептизацию. Пептизацию используют для получения жидких дисперсных систем из порошков или паст в химической и пищевой технологии. Важная роль принадлежит пептизации в совокупности процессов, определяющих моющее действие, формирование и разрушение различных дисперсных структур. Иногда пептизация вредна, например при водоочистке, осветлении вин и др.
Окислительно-восстановительные реакции. Электрохимические системы.
1. Окислительно-восстановительная способность веществ. Типы ОВР.
Окислительно-восстановительными реакциям называют такие химические процессы, в результате которых изменяются степени окисления одного или нескольких элементов.
Любая окислительно-восстановительная реакция (ОВР) состоит из двух сопряженных процессов:
1. Окисление – это процесс отдачи электронов частицей, который приводит к повышению С.О. элемента

2. Восстановление – это процесс приема электронов частицей, который сопровождается уменьшением С.О. элемента
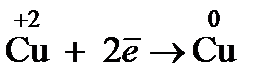
Вещества, отдающие свои электроны в процессе окисления, называются восстановителями, а вещества, принимающие электроны в процессе восстановления, являются окислителями. Если обозначить через Ох окисленную форму вещества, а через Red – восстановленную, то любая ОВР может быть представлена в виде суммы двух процессов:
Red 1 – n ē ® Ox 1 (окисление);
Ox 2 + n ē ® Red 2 (восстановление).
Типы ОВР
Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными. Например

В некоторых реакциях окислителем и восстановителем являются атомы различных по природе элементов одной и той же молекулы, такие ОВР называются внутримолекулярными. Например

Реакции, в ходе которых окислителем и восстановителем является атом одного и того же элемента, находящегося в составе одного и того же вещества, называются реакциями диспропорционирования (иначе самоокисления-самовосстановления или дисмутации). Например
 .
.
2. Метод электронного баланса.
Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Метод полуреакций применим для составления уравнений только таких окислительно-восстановительных процессов, которые протекают в растворах. Однако он имеет ряд преимуществ по сравнению с методом электронного баланса. В частности, при его использовании нет необходимости определять степени окисления элементов, кроме того, учитывается роль среды и реальное состояние частиц в растворе.
Основные этапы составления уравнений реакций по методу электронного баланса состоят в следующем:
1. Записывают схему реакции, определяют С.О. элементов, выявляют окислитель и восстановитель. Например:
 …
…
Очевидно, что С.О. изменяется у марганца (уменьшается) и у железа (увеличивается), таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель.
2. Составляют полуреакции окисления и восстановления
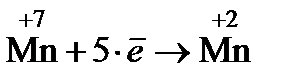 (восстановление)
(восстановление)
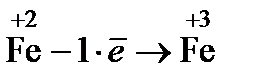 (окисление)
(окисление)
3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами
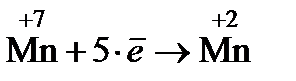 ½´ 1½´ 2
½´ 1½´ 2
 ½´ 5½´ 10
½´ 5½´ 10
Если коэффициенты кратны друг другу, их следует уменьшить, поделив каждый на наибольшее общее кратное. Если коэффициенты нечетные, а формула хотя бы одного вещества содержит четное количество атомов, то коэффициенты следует удвоить.
Так, в рассматриваемом примере коэффициенты перед электронами нечетные (1 и 5), а формула Fe2(SO4)3 содержит два атома железа, поэтому коэффициенты увеличиваем в два раза.
4. Записывают суммарную реакцию электронного баланса, при этом количество принятых и отданных электронов должно быть одинаковым и сократиться на данном этапе уравнивания

5. Расставляют коэффициенты в молекулярном уравнении реакции и вносят недостающие вещества. При этом коэффициенты перед веществами, которые содержат атомы элементов изменявших С.О., берутся из суммарной реакции электронного баланса, а атомы остальных элементов уравнивают обычным способом, соблюдая следующую последовательность:
- атомы металлов;
- атомы неметаллов (кроме кислорода и водорода);
- атомы водорода;
- атомы кислорода.
Для рассматриваемого примера
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
3. Метод ионно-электронных уравнений.
При уравнивании реакций методом ионно-электронных уравнений следует соблюдать следующую последовательность действий:
1. Записывают схему реакции, определяют С.О. элементов, выявляют окислитель и восстановитель. Например:

С.О. изменяется у хрома (уменьшается) и у железа (увеличивается), таким образом, K2Сr2O7 – окислитель, а Fe – восстановитель.
2. Записывают ионную схему реакции. При этом сильные электролиты записываются в виде ионов, а слабые электролиты, нерастворимые и малорастворимые вещества, а также газы оставляют в молекулярном виде. Для рассматриваемого процесса
K+ + Cr2O 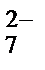 + Fe + H+ + SO
+ Fe + H+ + SO 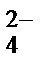 ® Cr3+ + SO
® Cr3+ + SO  + Fe2+ + H2O
+ Fe2+ + H2O
3. Составляют уравнения ионных полуреакций. Для этого сначала уравнивают количество частиц, содержащих атомы элементов, изменявших свои С.О.
Cr2O 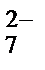 ® 2Cr3+
® 2Cr3+
Fe ® Fe2+
Далее уравнивают кислород и водород, используя частицы, определяющие характер раствора. Возможны три случая:
1) реакция в среде сильных кислот (рН < 7). В этом случае в уравнениях полуреакций рационально применять только ионы Н+ или молекулы Н2О. Если необходимо уменьшить количество атомов кислорода, то его связывают в молекулы воды, а если требуется добавить атом кислорода, то добавляют молекулу воды, при этом освобождается два иона водорода;
2) реакция в среде сильных оснований (рН > 7). Если необходимо отнять у соединения атом кислорода, то добавляют молекулу воды и освобождают два гидроксид иона, а если требуется добавить один атом кислорода, то вносят два иона ОН– и получают одну молекулу воды.
3) реакция в нейтральной среде (рН = 7). В таких реакциях рекомендуется в левую часть полуреакции добавлять только воду. При этом если нужно отдать кислород, то добавляют молекулу воды и получают два гидроксид иона, а если нужно добавить атом кислорода, то добавляют молекулу воды и получают два иона водорода.
Для рассматриваемого примера
Cr2O 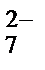 + 14Н+® 2Cr3+ + 7Н2О
+ 14Н+® 2Cr3+ + 7Н2О
Fe ® Fe2+
Затем уравнивают заряды с помощью прибавления или отнятия определенного количества электронов
[Cr2O 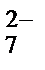 + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
Fe0 – 2 ē ® Fe2+
4. Балансируют количество принятых и отданных электронов так, как это описано в методе электронного баланса
[Cr2O 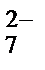 + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
Fe0 – 2 ē ® Fe2+ ½´6½´3
5. Записывают суммарную реакцию ионно-электронного баланса
Cr2O 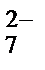 + 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
+ 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
6. Расставляют коэффициенты в молекулярном уравнении реакции
K2Cr2O7 + 3Fe + 7H2SO4 = Cr2(SO4)3 + 3FeSO4 + K2SO4 + 7H2O
4. ЭДС окислительно-восстановительного процесса, направление протекания ОВР.
Возможность и полноту самопроизвольного протекания ОВР в изобарно-изотермических условиях, как и любого другого химического процесса, можно оценить по знаку изменения свободной энергии Гиббса системы D G в ходе процесса.
Самопроизвольно при Р,Т = const в прямом направлении могут протекать реакции, для которых D G < 0.
Изменение энергии Гиббса окислительно-восстановительного процесса также равно электрической работе А элект, которую совершает система по перемещению электронов от восстановителя к окислителю, то есть
 (2)
(2)
где D Е – ЭДС окислительно-восстановительного процесса, В; F – постоянная Фарадея (F = 96485» 96500 Кл/моль); nē – число электронов, участвующих в данном процессе.
Из уравнения (2) вытекает, что условием самопроизвольного протекания ОВР в прямом направлении является положительное значение ЭДС окислительно-восстановительного процесса (D Е > 0). Расчет ЭДС ОВР в стандартных условиях следует вести по уравнению
 (3)
(3)
где Е  - стандартные окислительно-восстановительные потенциалы систем.
- стандартные окислительно-восстановительные потенциалы систем.
5. Электродный потенциал. Условные электродные потенциалы.
Каждый электрод, характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ). СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р 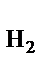 = 1 атм.) и раствором, в котором активность ионов водорода а
= 1 атм.) и раствором, в котором активность ионов водорода а 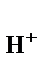 = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
Н+ +  «½ Н2
«½ Н2
Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е 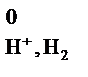 = 0 В).
= 0 В).
6. Гальванические элементы. ЭДС гальванического элемента.
Гальваническим элементом называют устройство для прямого преобразования энергии химической реакции в электрическую, в котором реагенты (окислитель и восстановитель) входят непосредственно в состав элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать, то есть это ХИТ одноразового действия.
ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией.
Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода
D Е = Е катод - Е анод (11)
Поскольку потенциал катода всегда больше потенциала анода, то из формулы (11) следует, что в работающем гальваническом элементе D Е > 0.
Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами.
Например, Zn | Zn2+ || Cu2+ | Cu или с учетом анионов Zn | ZnSO4 || CuSO4 | Cu
7. Электролиз. Законы Фарадея.
Электролизом называют окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую, что позволяет осуществлять такие ОВР, которые не могут протекать самопроизвольно.
Ячейка, в которой осуществляют электролиз, называется электролизёр и состоит из двух электродов и электролита. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом – на нем происходит окисление. Электрод, подключенный к отрицательному полюсу – катод, на нем идет восстановительный процесс.
Первый закон Фарадея: масса вещества, испытавшего электрохимические превращения на электроде, прямо пропорциональна количеству прошедшего электричества
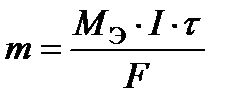 , (13)
, (13)
где m – масса вещества, г; M Э – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с.
Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой
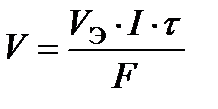 , (14)
, (14)
где V Э – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3.
Второй закон Фарадея: массы (объемы) веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы (объемы) их эквивалентов
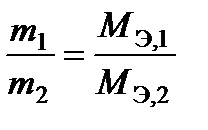 или
или 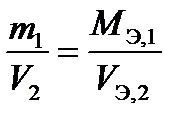 (15)
(15)
Для оценки эффективности работы электролизера пользуются понятием выход продукта по току h. Иначе, это коэффициент полезного действия электролизера
 , (16)
, (16)
где m эксп - масса вещества, испытавшего превращение на электроде, при прохождении определенного количества электричества, найденная экспериментально, г; m теор - масса вещества, вычисленная по закону Фарадея, при том же количестве электричества, г.
8. Катодные и анодные процессы при электролизе водных растворов.
Электролиз водных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекулы воды:
1. восстанавливаться на катоде по схеме
2Н2О + 2 ē ® Н2 + 2ОН–;
2. окисляться на аноде по схеме
2Н2О – 4 ē ® О2 + 4Н+.
Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает:
1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала;
2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала.
При реализации данных принципов на практике следует вычислить потенциалы всех возможных процессов и сравнить их между собой.
На катоде могут возникнуть три случая:
1. Потенциал восстановления катиона Е  больше потенциала восстановления воды Е
больше потенциала восстановления воды Е 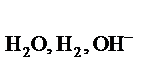 , причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
, причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
Mе n + + n×ē ® Me
2. Е  < Е
< Е 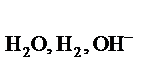 , причем
, причем  В, тогда на катоде идет процесс восстановления молекул воды.
В, тогда на катоде идет процесс восстановления молекул воды.
3. Е  » Е
» Е 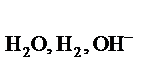 , то есть
, то есть  В, тогда на катоде идут сразу оба восстановительных процесса
В, тогда на катоде идут сразу оба восстановительных процесса
Mе n + + 2Н2О + (2 + n)× ē ® Me + Н2 + 2ОН–
Для процессов на аноде в первую очередь следует определить тип анода. Если анод растворимый, то тогда независимо от состава электролита будет происходить окисление материала анода. Например, для железного анода
Fe – 2 ē ® Fe2+
Если анод инертный, то окислению будет подвергаться одна из частиц электролита. В реальных процессах порядок разряда частиц на инертном электроде зависит не только от окислительно-восстановительного потенциала системы, но и от перенапряжения. А нодное перенапряжение при окислении молекул воды (кислородное перенапряжение), то есть сдвиг потенциала окисления Н2О в положительную сторону, связано с кинетическими затруднениями при образовании молекулы О2. В результате теоретически выделение кислорода должно начинаться при потенциале +0,815 В, а практически это происходит только при напряжении более +1,5 В.
При реализации процессов окисления на инертном аноде выполняются следующие правила:
1. В первую очередь на инертных анодах в разбавленных водных растворах окисляются простые анионы в порядке возрастания их стандартных потенциалов, не превышающих +1,5 В, то есть S2-, I–, Br–, Cl–. Вода при этом не окисляется.
2. При электролизе водных растворов, содержащих анионы кислородсодержащих кислот (СО  , NO
, NO  , SO
, SO  и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
2Н2О – 4× ē ® О2 + 4Н+,
а в щелочных растворах ионы ОН– по схеме
4 ОН– – 4 ē ® О2 + 2Н2О.
9. Коррозия металлов и ее виды. Показатели скорости коррозии.
Коррозия – это самопроизвольное разрушение металлов или сплавов металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии. Причиной коррозионных разрушений является термодинамическая неустойчивость материалов в естественных условиях, т.е. изменение энергии Гиббса процесса коррозии должно быть отрицательным (DG < 0).
По механизму протекания различают химическую и электрохимическую коррозию.
Химическая коррозия протекает в средах, не проводящих электрический ток, таких как сухие газы или растворы неэлектролитов. В результате химической коррозии металл покрывается слоем продуктов его окисления – чаще всего пленкой оксида или гидрооксида. Образующаяся пленка препятствует диффузии окислителя к чистому металлу и тем самым замедляет, а иногда и полностью прекращает дальнейшую коррозию металла.
Электрохимическая коррозия наблюдается в средах, способных проводить электрический ток – влажный воздух, вода, водные растворы солей, кислот и оснований, почва и др. Данный вид коррозии протекает по механизму действия гальванического элемента, в котором окислительный (анодный) и восстановительный (катодный) процессы разделены в пространстве.
Окисляющиеся участки металла (анодные участки) имеют меньшее значение потенциала, на них металл в виде ионов переходит в водную среду по реакции
Mе – nē ® Me n +
При этом на металле накапливается отрицательный заряд.
На катодных участках, то есть участках с более высоким значением потенциала, восстанавливаются частицы окислителя
Ox + n ē ® Red.
Так как окислитель принимает электроны, то есть снимает избыточный отрицательный заряд с поверхности металла (деполяризует его), то его называют деполяризатор.
Причинами энергетической неоднородности поверхности металла, которые приводят к образованию короткозамкнутых макро- или микрогальванических пар, являются:
1. Наличие контактов двух или более металлов, обладающих различными значениями потенциалов;
2. Наличие примесей в металле или продуктов его окисления на поверхности;
3. Внутренние напряжения в конструкции из металла и др.
Окислителями при электрохимической коррозии чаще всего служат молекулы кислорода, растворенного в воде или ионы Н+. При этом на катодных участках могут происходить процессы:
1. В нейтральной или щелочной среде
О2 + 2Н2О + 4  ® 4ОН– (коррозия с кислородной деполяризацией)
® 4ОН– (коррозия с кислородной деполяризацией)
2. В кислой среде
О2 + 4Н+ + 4  ® 2Н2О (коррозия с кислородной деполяризацией)
® 2Н2О (коррозия с кислородной деполяризацией)
или 2Н+ + 2  ® Н2 (коррозия с водородной деполяризацией)
® Н2 (коррозия с водородной деполяризацией)
Возможность протекания коррозии того или иного металла следует определять следующим образом: сравнить потенциал металла (восстановителя) с потенциалом окислителя. Если Е 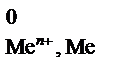 < Е
< Е  , то металл может подвергаться коррозии.
, то металл может подвергаться коррозии.
При оценочных расчетах можно считать, что потенциал процесса с кислородной деполяризацией равен +0,815 В, а потенциал процесса с водородной деполяризацией можно оценивать при помощи уравнений (5) или (6).
10. Способы защиты металлов от коррозии.
Основными способами защиты металлов от коррозии являются легирование металлов, нанесение защитных покрытий, методы электрохимической защиты, применение замедлителей (ингибиторов) коррозии и приемы рационального конструирования изделий из металлов.
Одним из самых доступных и чаще всего применяемых методов защиты является нанесение на металлы покрытий, которые бывают металлическими и неметаллическими.
Материалами для металлических покрытий могут служить как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром и др.), так и их сплавы (бронза, латунь и др.).
По характеру поведения металлических покрытий при коррозии их делят на катодные и анодные. К катодным покрытиям относят покрытия, выполненные из металлов, имеющих большее значение потенциала, чем у основного (защищаемого) металла. При повреждении такого покрытия возникает макрогальванический элемент, в котором защищаемый металл становится анодом и растворяется, а металл покрытия – катодом, на котором восстанавливаются частицы окислителя. Таким образом, катодные покрытия являются защитными, только пока они не повреждены. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. В случае повреждения анодного покрытия его защитное действие не прекращается, так как в созданном гальваническом элементе основной металл – катод, то есть не окисляется, а металл покрытия – анод.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1599; Нарушение авторских прав?; Мы поможем в написании вашей работы!