
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действующих масс. Константа равновесия для газофазных реакций
|
|
|
|
Допустим, что между газообразными веществами А1, А2 … Аi, А’1, А’2 … А’i протекает химически обратимая реакция по уравнению:
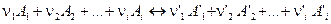
Химическая реакция протекает самопроизвольно до тех пор, пока не достигнуто химическое равновесие между реагирующими веществами. Химическое равновесие является динамическим равновесием, при котором скорости прямой и обратной реакций равны.
Состояние химического равновесия определяется двумя признаками:
– если система находится в состоянии равновесия, то ее состав с течением времени при постоянных внешних условиях не изменяется
– если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится в исходное состояние. При этом достижение состояния равновесия возможно в результате как прямого, так и обратного процессов.
При практическом определении равновесия химических реакций, протекающих сравнительно быстро, часто руководствуются только первым признаком.
Однако, постоянство состава системы, в которой реакция протекает очень медленно, может быть только кажущимся, и на этом основании нельзя делать вывод о том, что система находится в состоянии химического равновесия. Примером может служить медленная реакция между водородом и кислородом при низких температурах. Любая смесь водорода, кислорода и водяных паров при низких температурах может оставаться неизменной в течение очень длительного промежутка времени, но достаточно определенного воздействия извне (например, введения платинового катализатора), чтобы вещества, входящие в состав смеси, прореагировали между собой. При прекращении внешнего воздействия рассматриваемая система уже не вернется в исходное состояние, так как до этого она не находилась в состоянии устойчивого равновесия.
При установлении в системе химического равновесия согласно (IV, 11)
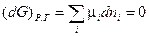
Подстановка выражения для 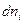 из уравнения (I, 58) для равновесного процесса приводит к соотношению:
из уравнения (I, 58) для равновесного процесса приводит к соотношению:
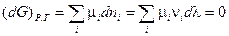
Из этого следует, что 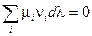
Так как химическая реакция протекала, то 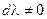 . Следовательно,
. Следовательно,
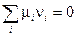 (V, 1)
(V, 1)
Напомним, что в последнем выражении слагаемые для исходных веществ должны быть взяты со знаком «–», а для продуктов реакции — со знаком «+».
Подстановка в уравнение (V, 1) выражения для химического потенциала из (III, 52) дает
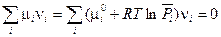
Тогда
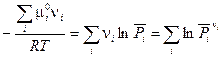 (V, 2)
(V, 2)
В результате потенцирования уравнения (V,2) будем иметь
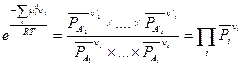 (V, 3)
(V, 3)
Так как стандартный химический потенциал 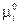 зависит только от природы индивидуального i –ого реагента и температуры, то при T = const левая часть в уравнении (V, 3) является постоянной величиной и называется стандартной константой равновесия реакции К0.
зависит только от природы индивидуального i –ого реагента и температуры, то при T = const левая часть в уравнении (V, 3) является постоянной величиной и называется стандартной константой равновесия реакции К0.
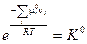 (V, 4)
(V, 4)
Стандартная константа равновесия является безразмерной величиной.
В соответствии с (V, 3) для системы, компоненты которой подчиняются законам идеального газа, можно получить:
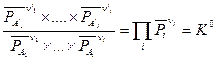 (V, 5)
(V, 5)
Уравнение (V,5) называется законом действующих масс.
Если исходить из уравнения (III, 54), определяющего химический потенциал через мольные доли, то выражение (V, 1) можно записать в следующем виде:
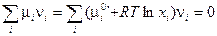
Тогда тем же путем можно вывести закон действующих масс в ином виде:
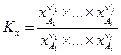 ,
,
Где 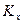 — константа равновесия, выраженная через мольные доли. В связи с тем, что
— константа равновесия, выраженная через мольные доли. В связи с тем, что 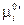 в уравнении (III, 54) зависит не только от температуры, но и давления,
в уравнении (III, 54) зависит не только от температуры, но и давления, 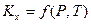 .
.
Закон действующих масс для газофазных реакций также часто записывается еще в двух формах:
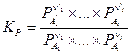 и
и
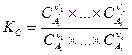 ,
,
где Pi — парциальное давление и Ci — концентрация i – ого компонента в равновесной газовой смеси.
Отметим, что константы KP и KC являются в общем случае размерными величинами.
Соотношение между константами K c, KP и KC легко найти, если принять во внимание следующие соотношения:
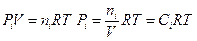 и
и
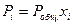
Тогда
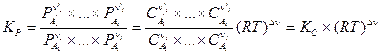 и
и
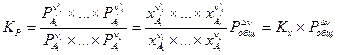 или
или
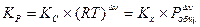 , (V, 6)
, (V, 6)
где 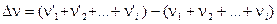
Очевидно, что KP = KC = K c при условии, что число молей реагирующих веществ в ходе реакции не меняется, то есть, если Dn = 0.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 618; Нарушение авторских прав?; Мы поможем в написании вашей работы!