
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молярные массы эквивалентов сложных веществ можно определять
|
|
|
|
Химическим эквивалентом вещества называют такое его количество, которое соединяется полностью с одним моль атомов водорода или замещает такое же количество водорода в его соединениях.
В равных объемах различных газов при одинаковых условиях
(t0С, P) содержится одно и то же число молекул. Законсформулирован итальянским физиком Авогадро в 1811г и имеет ряд следствий.
Следствие 1. В одном моле вещества содержится 6, 02 ∙10 23 молекул.
Значение 6, 02 ∙ 10 23 моль –1 называют числом
Авогадро(N A ).
Следствие 2. Один моль любого газа при нормальных условиях (н.у.)
(00С(273 K), 1,03 . 105 Па) занимает объем 22,4 л/моль.
1 моль О2 (М(О2)=32 г/моль) – содержит 6,02•1023 молекул кислорода, он занимает объем 22,4 л/моль.
1 моль Н2 (М(Н2)=2 г/моль) – содержит 6,02•1023 молекул водорода, он занимает объем 22,4 л/моль.
Задача. Какой объем водорода выделится при травлении 3,25 г Zn соляной кислотой?
Для решения задачи записываем уравнение реакции:
Zn + 2 HCl → ZnCl2 + H2
65 22,4
где 65 – молярная масса цинка; 22,4 – молярный объем водорода.
При травлении 65 г цинка выделится 22,4 л/моль водорода, а при травлении 32,5 г цинка выделится Х л водорода. Найдем объем выделившегося водорода при н.у.
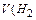 ) = X =
) = X = 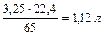
В результате работ немецкого химика Рихтера, английских ученых Дальтона и Волластона (1792 – 1800 г.) были установлены так называемые “соединительные веса” или эквиваленты реагирующих веществ.
Например, в соединениях НС1, H2О, NH3 эквиваленты хлора, кислорода, азота соответственно равны 1 моль, 1/2 моль, 1/3 моль. За единицу эквивалента принят эквивалент водорода Э (Н) =1 моль атомов). Эквивалент выражают в молях. Кроме понятия эквивалент пользуются понятием молярная масса эквивалента.
Молярная масса эквивалента – это масса одного химического эквивалента вещества МЭ (Н) = 1 г/моль; МЭ (N) = 14∙1/3 = 4,67 г/моль; МЭ (Cl) = 35,45 г/моль; МЭ (S) = 32∙1/2 = 16 г/моль.
Молярная масса эквивалента элемента равна отношению молярной массы элемента (М) к его валентности (В). Например:
S+4O2, валентность серы равна IV; MЭ (S+4) = M(S)/B = 32/4 = 8 г/моль;
S+6O3, валентность серы равна VI; MЭ (S+6) = M(S)/B = 32/6 = 5,3 г/моль.
Для газообразных веществ удобно пользоваться эквивалентным объемом.
Эквивалентный объем (Vэ) – это объем, занимаемый одним химическим эквивалентом газообразного вещества при нормальных условиях. Эквивалентная масса водорода составляет 1/2 его моля (M(H2)=2 г/моль). Молярный объем водорода равен 22,4 л (н.у.), тогда эквивалентный объем водорода равен 11,2 л/моль. Эквивалентная масса кислорода составляет 1/4 его моля, (M(О2)= 32 г/моль).
Молярный объем кислорода составляет 22,4 л/моль (н.у.), тогда эквивалентный объем кислорода равен 5,6 л/моль.
Для оксида:
1 способ: МЭ(Al2O3) = 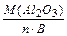 , где n – число атомов элемента в молекуле; В – его валентность. МЭ (Al2O3) = 102/2∙3 = 17 г/моль
, где n – число атомов элемента в молекуле; В – его валентность. МЭ (Al2O3) = 102/2∙3 = 17 г/моль
2 способ: МЭ (Al2O3) = МЭ (O-2) + МЭ(Al+3) =16/2 + 27/3 =17г/моль
Для основания:
1 способ: МЭ (Са(ОН)2) = 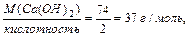 где кислотность основания- это число (ОН-)-групп в молекуле основания, вступивших в реакцию.
где кислотность основания- это число (ОН-)-групп в молекуле основания, вступивших в реакцию.
2 способ: МЭ (Са(ОН)2) = МЭ (Са2+) + МЭ (ОН-) = 40/2 + 17 = 37 г/моль
Для кислоты:
1 способ: МЭ (H3PO4) = 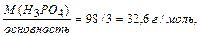 где основность кислоты– это число катионов Н+ в молекуле кислоты, вступивших в реакцию.
где основность кислоты– это число катионов Н+ в молекуле кислоты, вступивших в реакцию. 
2 способ:
МЭ (Н3РО4) = МЭ (Н+) + МЭ (РО43-) = 1+ 95/3 = 1+ 31,6 = 32,6 г/моль.
Для соли:
1 способ: МЭ (Са3(РО4)2)= 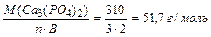
МЭ (Nа HCO3) = 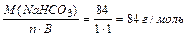
МЭ (A1 (OH)C12) = 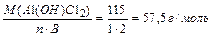 ,
,
где В – валентность металла или заряд катиона для основной соли.
n – число атомов металла в молекуле соли.
2 способ:
МЭ (Са3(РО4)2) = МЭ (Са2+) + МЭ (РО43-) = 40/2 + 95/3 = 51,7 г/моль;
МЭ(NaHCO3) = МЭ (Na+) + МЭ (HCO3-) = 23 + 61 = 84 г/моль;
МЭ (А1ОНС12) = МЭ (А1ОН2+) + МЭ (С1-) = 44/2 + 35,5 = 57,5г/моль.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 521; Нарушение авторских прав?; Мы поможем в написании вашей работы!