
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стехиометрические законы химии
|
|
|
|
КРАТКИЙ КОНСПЕКТ ЛЕКЦИЙ ПО ХИМИИ
КРАТКИЙ КОНСПЕКТ ЛЕКЦИЙ ПО ХИМИИ
КРАТКИЙ КОНСПЕКТ ЛЕКЦИЙ ПО ХИМИИ
Лекции по медицинской антропологии
Учебное пособие
2-е изд., дополненное и переработанное
Редактор Л.А. Алехнович
Подписано к печати 29.08.2008. Объем 5,23 усл. п. л.
Тираж 500 экз. Заказ № 1027..
Отпечатано в типографии «Новый ветер».
410012, г. Саратов, ул. Б. Казачья, 113
для студентов заочной формы обучения.
Луганск ВНУ 2003
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ВОСТОЧНОУКРАИНСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ
имени ВЛАДИМИРА ДАЛЯ
для студентов заочной формы обучения всех инженерных специальностей
УТВЕЖДЕНО
на заседании кафедры химии
Протокол №____ от..
Луганск ВНУ 2003
УДК54
для студентов заочной формы обучения всех инженерных специальностей.
/ Сост: С.П. Бугрим, И.А. Хоружая. -Луганск: Изд-во Восточноукр. нац. ун-та, 2003. –104с.
Краткий конспект лекций по химии включает 12 лекций с примерами решения типовых задач и указанием литературных источников по основным темам курса: «Стехиометрические законы химии», «Квантовомеханическое представление о строении атома», «Правила и порядок заполнения атомных орбиталей», «Периодический закон Д.И.Менделеева. Закономерности периодической системы», «Химическая термодинамика», «Второе начало химической термодинамики», «Химическая кинетика», «Растворы электролитов, слабые электролиты», «Комплексные соединения», «Окислительно-восстановительные реакции», «Основы электрохимии», «Химические источники тока», «Коррозия металлов и защита металлов от коррозии», «Электролиз». Краткий конспект лекций отвечает требованиям программы курса химии для технических специальностей. Рекомендован для студентов заочной формы обучения всех инженерных специальностей.
.
Составители: С.П. Бугрим, ст. преп., И.А. Хоружая,доц.кафедры
химии им.В.Даля химии ВНУ
Отв. за выпуск: В.Л. Абраменко, доц.
Рецензенты: А.А. Григорьева, доц.
План
1. Закон сохранения материи.
2. Закон постоянства состава Пруста.
3. Закон Авогадро. Следствия из закона Авогадро.
4. Закон эквивалентных отношений.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Стехиометрией называется раздел химической науки, который изучает количественные отношения между веществами в химических процессах. Стехиометрия лежит в основе химического анализа и является фундаментом в развитии теоретической химии.
Основные стехиометрические законы:
1. Закон сохранения материи.
Масса веществ, вступающих в химическую реакцию равна массе веществ, образующихся в результате ее. Закон был высказан в 1748 г. и обоснован в 1756г. русским ученым М.В. Ломоносовым.
С точки зрения атомно-молекулярного учения смысл закона сохранения массы веществ заключается в том, что атомы имеют постоянную массу, а их общее количество в ходе реакции не изменяется, поэтому масса веществ до и после реакции остается постоянной. Например:
а) 2Mg + O2 → 2MgO б) (NH4)2 Cr2 O7 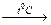 N2 + Cr2O3 + 4H2O
N2 + Cr2O3 + 4H2O
2∙24 + 16∙2 → 2(24+16)28 + 152 + 72
80 → 80 252 ® 252
На основании закона сохранения массы можно составлять химические уравнения и по ним производить необходимые расчеты.
Задача. Сколько выделится Pb, если при погружении в раствор Pb(NO3)2 цинковой  пластинки ее масса увеличилась на 7,1 г?
пластинки ее масса увеличилась на 7,1 г?
Для решения задачи необходимо записать уравнение реакции:
Pb(NO3)2 + Zn → Zn(NO3)2 + Pb,
65 207
где 65 – молярная масса цинка; 207 – молярная масса свинца. По уравнению реакции, при увеличении массы цинковой пластинки на 142 грамма (207-65)- свинца выделится 207г, а при увеличении массы цинковой пластинки на 7,1 г – свинца выделится X г. Найдем массу свинца.
X=(mPb)= 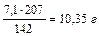 .
.
2. Закон постоянства состава.
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный количественный и качественный состав. Закон был сформулирован французским ученым Ж.Л.Прустом в 1808 году.
Например, молекула воды имеет постоянный количественный (на два атома водорода приходится один атом кислорода) и качественный состав (Н; О), не зависимо от способов получения:
CuO + H2 ® H2O + Cu
CH4 + 2O2 ® 2H2O + CO2
C2H5OH + 3O2 ® 3H2O + 2CO2
H2SO4 + 2NaOH ® 2H2O + Na2SO4
Чистота веществ определяется по t0C плавления, t0Скипения, плотности, спектрам.
3. Закон Авогадро.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 486; Нарушение авторских прав?; Мы поможем в написании вашей работы!