
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы электрохимии
|
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
План
1. Окислительно-восстановительные реакции (ОВР). Их классификация.
2. Направление протекания ОВР.
3. Основы электрохимии:
3.1. двойной электрический слой; равновесный электродный потенциал;
3.2. стандартный электродный потенциал;
3.3. электрод сравнения (стандартный водородный электрод);
3.4. уравнение Нернста;
3.5. ряд напряжений металлов.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Ахметов Н.С.Общая и неорганическая химия. Раздел V, гл.3,4.
4. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.



Электрохимия – это раздел химии, который изучает химические процессы, в результате которых возникает электрический ток или химические процессы, протекающие под действием электрического тока.
В основе таких химических процессов лежат ОВР.
Окислительно-восстановительные реакции – это электронодинамические реакции, сопровождающиеся переходом электронов от восстановителя к окислителю и изменением степеней окисления атомов, входящих в состав реагирующих веществ.
Степень окисления (С.О.) – это формальный электрический заряд атома элемента в химическом соединении, при условии, что все образуемые этим атомом связи носят чисто ионный характер.
Степень окисления элементов определяется с учетом следующих правил:
1.С.О. (элемента в простом веществе)=0
2.C.O. (O)= -2(искл.F2O+2;R2O-12).
3.С.О. (Н)=+1(искл. гидриды металлов Na+H-).
4.С.О. (иона)=его заряду Z (Na+ 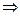 C.O.=+1; F-
C.O.=+1; F- 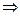 C.O.= -1)
C.O.= -1)
5.Закон электронейтральности: в молекуле алгебраическая сумма степеней окисления элементов с учетом числа их атомов равна нулю. Например, K+1MnxO-24
+1+x+4•(-2)=0 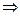 x=+7
x=+7
Окислитель – вещество, которое принимает электроны и при этом восстанавливается.
Важнейшие окислители:
1.Неметаллы, переходящие в процессе ОВР в отрицательно заряженные ионы:
F02 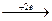 2F - (Cl2; I2; O2; Br2; S),
2F - (Cl2; I2; O2; Br2; S),
2. Катионы металлов и катион водорода Н+, переходящие в процессе ОВР в нейтральное состояние:
Ag+ 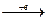 Ag0
Ag0
2H+ 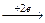 H02
H02
3. Сложные вещества, в состав которых входят атомы элементов, в высших степенях окисления, переходящие в процессе ОВР в более низкие степени окисления.
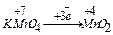
Восстановитель – это вещество, которое отдает электроны и при этом окисляется.
Важнейшие восстановители:
1.Все металлы и некоторые неметаллы(H2; B; C) переходящие в процессе ОВР в состояние с положительными степенями окисления.
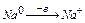
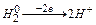
2.Сложные вещества, в состав которых входят элементы с низкими степенями окисления, переходящие при ОВР в более высокие степени окисления.
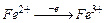
(FeCl2) (FeCl3)
Типы ОВР:
1. Межмолекулярные ОВР – реакции, в ходе которых окислитель и восстановитель находятся в разных веществах:
Mn+4O2+4HCl-=Mn2+Cl2+Cl02+2H2O
2. Внутримолекулярные ОВР – реакции, в ходе которых окислитель и восстановитель (атомы разных элементов) находятся в составе одного вещества: 2KCl+5O-23=2KCl-1+3O02.
3. ОВР диспропорционирования – реакции, в ходе которых атомы одного и того же элемента, находящиеся в составе вещества, являются и окислителем и восстановителем:
Cl02+2KOH=KCl-+KCl+1O+H2O
При составлении уравнений ОВР должен соблюдаться электронный баланс, т.е. число электронов, отданных восстановителем, должно соответствовать числу электронов, принятых окислителем. Вычислив степени окисления участвующих и образующихся в результате реакции частиц, определяем восстановитель и окислитель.


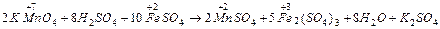
окислитель [ Mn+7O4]- + 8H+ + 5ē → Mn2+ + 4H2O 5 2 Е0=+1,51 (В)
восстановитель Fe2+ - ē → Fe3+ 1 10 ЕВ= +0,77(В)
 Для написания молекулярного уравнения дописываем противоионы.
Для написания молекулярного уравнения дописываем противоионы.
2[MnO]-4 +16H+ + 10Fe2+ → 2Mn2 + + 10Fe3+ + 8H2O
2K+ 8[SO4]2- 10SO42- → 2[SO4]2- 15[SO4]-2 2 K+SO4 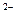
В растворах стремление электронов к переходу от одних атомов или ионов к другим характеризуется стандартным окислительно-восстановитель-ным потенциалом Е0(В).
Возможность и направление протекания ОВР определяется величиной ЭДС, которая расчитывается как разность потенциалов окислителя (Е0) и восстановителя (ЕВ).
ЭДС = Е0 – ЕВ, если ЭДС = ΔΕ>0 реакция возможна;
ΔΕ >0,2 (В) идет хорошо; ΔΕ <0 реакция невозможна.
Для приведенной реакции ЭДС=Е0-ЕВ=1,51-0,77=0,74(В), значит, реакция протекает в прямом направлении достаточно хорошо.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 626; Нарушение авторских прав?; Мы поможем в написании вашей работы!