
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация воды. Водородный показатель
|
|
|
|
Важной особенностью жидкой воды является ее способность к самопроизвольной диссоциации по реакции:
Н2О(ж) «Н+(водн) + ОН-(водн)
Этот процесс называется еще самоионизацией или автопротолизом. Образовавшиеся протоны Н+ и анионы ОН- окружены определенным числом полярных молекул воды, т.е. гидратированы: Н+×nH2O; OH-×mH2O. Первичная гидратация может быть представлена рядом аквакомплексов: Н3О+; Н5О2+; Н7О3+; Н9О4+, среди которых преобладают ионы Н9О4+ (Н+×4H2O). Время жизни всех этих ионов в воде очень мало, т.к. протоны постоянно мигрируют от одних молекул
воды к другим. Обычно в уравнениях для простоты используют только катион состава Н3О+ (Н+×H2O), называемый ионом гидроксония.
Процесс диссоциации воды с учетом гидратации протона и образования иона гидроксония может быть записан: 2Н2О «Н3О+ + ОН-
Вода – слабый электролит, степень диссоциации которого
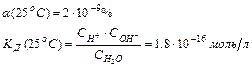
Поскольку 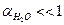 à Сравн(Н2О)» Сисх(Н2О) или [Н2О]равн ≈ [Н2О]исх
à Сравн(Н2О)» Сисх(Н2О) или [Н2О]равн ≈ [Н2О]исх
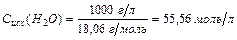 – количество молей содержащееся в одном литре воды. Сисх(Н2О) в разбавленном растворе остается постоянной. Это обстоятельство позволяет включить Сравн(Н2О) в константу равновесия.
– количество молей содержащееся в одном литре воды. Сисх(Н2О) в разбавленном растворе остается постоянной. Это обстоятельство позволяет включить Сравн(Н2О) в константу равновесия.
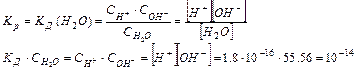
Таким образом, произведение двух постоянных величин 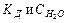 дает новую постоянную, которую называют ионным произведением воды
дает новую постоянную, которую называют ионным произведением воды 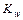 . При температуре 298 К
. При температуре 298 К 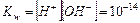 .
.
¾- Постоянство ионного произведения воды означает, что в любом водном растворе: кислотном, нейтральном или щелочном – всегда имеются оба вида ионов (Н+ и ОН-)
¾- В чистой воде концентрации водородных и гидроксильных ионов равны и при нормальных условиях составляют:
[H+] = [OH-] = Kw1/2 = 10-7 моль/л.
¾- При добавлении кислот концентрация [Н+] увеличивается, т.е. равновесие смещается влево, а концентрация [ОН-] уменьшается, однако Кw остается равной 10-14.
В кислой среде [H+] > 10-7 моль/л, а [OH-] < 10-7 моль/л
В щелочной среде [H+] < 10-7 моль/л, а [OH-] > 10-7 моль/л
На практике для удобства используют водородный показатель (рН) и гидроксильный показатель (рОН) среды.
Это есть взятый с обратным знаком десятичный логарифм концентраций (активностей) соответственно ионов водорода или гидроксильных ионов в растворе: рН = - lg[H+], рОН = - lg[OH-]
В водных растворах рН + рОН = 14.
Таблица№14.
| Растворы | ||
| Нейтральные | Кислые | Щелочные |
| рН = 7 | рН < 7 | рН > 7 |
Kw зависит от температуры (т.к. диссоциация воды – эндотермический процесс)
Kw (25 oC) = 10-14 Þ рН = 7
Kw (50 oC) = 5,47×10-14 Þ рН = 6,63
Измерение рН используется чрезвычайно широко. В биологии и медицине величина рН биологических жидкостей служит для определения патологий. Например, в норме рН сыворотки крови состовляет 7,4±0,05; слюны – 6,35..6,85; желудочного сока – 0,9..1,1; слез – 7,4±0,1. В сельском хозяйстве рН характеризует кислотность почв, экологическое состояние природных вод и т.д.
Кислотно-основными индикаторами называются химические соединения, изменяющие свою окраску в зависимости от рН среды, в которой они находятся. Вы, наверное, обращали внимание на то, как меняется цвет чая, если в него положить лимон – это пример действия кислотно-основного индикатора.
Индикаторы, как правило, представляют собой слабые органические кислоты или основания и могут существовать в растворах в виде двух таутомерных форм:
HInd «H+ + Ind-, где HInd – кислотная форма (это форма, которая преобладает в кислых растворах); Ind – основная форма (преобладает в щелочных растворах).
Поведение индикатора подобно поведению слабого электролита в присутствии более сильного с одноименным ионом. Чем больше [H+] следовательно равновесие смещается в сторону существования кислотной формы HInd и наоборот (принцип Ле-Шателье).
Опыт показывает наглядно возможность использования некоторых индикаторов:
Таблица№15
| Индикатор | рН < 7 | рН = 7 | рН > 7 |
| Метилоранж | красный | оранжевый | желтый |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Лакмус | красный | Фиолетовый | синий |
Специальные приборы – рН-метры позволяют измерять рН с точностью до 0,01 в интервале от 0 до 14. Определение основано на измерении ЭДС гальванического элемента, один из электродов которого является, например, стеклянным.
Наиболее точно концентрацию водородных ионов можно определить методом кислотно-основного титрования. Титрование – это процесс постепенного добавления небольшими порциями раствора известной концентрации (титранта) к титрируемому раствору, концентрацию которого хотим определить.
Буферные растворы – это системы, рН которых относительно мало изменяется при разбавлении или добавлении к ним небольших количеств кислот или щелочей. Чаще всего они представляют собой растворы, содержащие:
a) а)Слабую кислоту и ее соль(СН3СООН + СН3СООNa) – ацетатный буфер
в)Слабое основание и его соль(NH4OH + NH4Cl) – аммиачно-аммонийный буфер
с)Две кислые соли с разными Kд (Na2HPO4 + NaH2PO4) – фосфатный буфер
Регулирующий механизм буферных растворов рассмотрим на примере ацетатного буферного раствора.
CH3COOH «CH3COO- + H+, 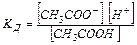
CH3COONa «CH3COO- + Na+
1. 1)если добавить небольшое количество щелочи к буферной смеси:
CH3COOH + NaOH «CH3COONa + H2O,
NaOH нейтрализуется уксусной кислотой с образованием более слабого электролита H2O. Избыток натрия ацетата смещает равновесие в сторону образовавшейся кислоты.
2. 2)если добавить небольшое количество кислоты:
CH3COONa + HCl «CH3COOH + NaCl
Катионы водорода Н+ связывают ионы CH3COO-
Найдем концентрацию ионов водорода в буферном ацетатном растворе:
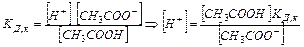
Равновесная концентрация уксусной кислоты рана Cисх,к (т.к. слабый электролит), а [СH3COO--] = Cсоли (т.к. соль является сильным электролитом), то 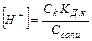 . Уравнение Гендерсона-Хассельбаха:
. Уравнение Гендерсона-Хассельбаха:
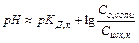
Таким образом, рН буферных систем определяется соотношением концентраций соли и кислоты. При разбавлении это соотношение не меняется и рН буфера не меняется при разбавлении, это отличает буферные системы от раствора чистого электролита, для которого справедлив закон разведения Оствальда.
Существует две характеристики буферных систем:
1. Буферная сила. Абсолютная величина буферной силы зависит от
общей концентрации компонентов буферной системы, т.е. чем больше концентрация буферной системы, тем больше требуется щелочи (кислоты) для одного и того же изменения рН.
2. Буферная емкость (В). Буферная емкость – это предел, в котором проявляется буферное действие. Буферная смесь поддерживает рН постоянным только при условии, что количество прибавляемых к раствору сильной кислоты или основания не превышает определенной предельной величины – В. Буферная емкость определяется числом г/экв сильной кислоты (основания), которое необходимо прибавить к одному литру буферной смеси, чтобы изменить значение рН на единицу, т.е. 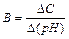 . Вывод: Свойства буферных систем:
. Вывод: Свойства буферных систем:
1. 1.[H+] мало зависит от разбавления.
2. 2.Прибавление сильных кислот (оснований) мало изменяет [H+] в пределах буферной емкости В.
3. 3.Буферная емкость зависит от буферной силы (от концентрации компонентов).
4. 4.Максимальное действие проявляет буфер в случае, когда кислота и соль присутствуют в растворе в эквивалентных количествах:
Ссоли = Ск-ты; [H+] = Кд,к; рН = рКд,к (рН определяется значением Кд).
Гидролиз – это химическое взаимодействие воды с солями. Гидролиз солей сводиться к процессу передачи протонов. В результате его протекания появляется некоторый избыток водородных или гидроксильных ионов, сообщающих раствору кислотные или щелочные свойства. Таким образом, гидролиз обратен процессу нейтрализации.
Гидролиз солей включает 2 стадии:
а)Электролитическая диссоциация соли с образованием гидратированных ионов:. KCl à K+ + Cl- K+ + xH2O à K+ × xH2O (связь донорно-акцепторная, донор – атом О, имеющий 2 неподеленные электронные пары,
акцептор – катионы с вакантными орбиталями)
Cl- + yH2O «Cl- ×yH2O (водородная связь)
в) Гидролиз по аниону. Cl- + HOH à HCl + OH-
с) Гидролиз по катиону. K+ + HOH à KOH +
Гидролизу подвергаются все соли, образованные с участием слабых
электролитов:
1.Соль, образованная анионом слабых кислот и катионом сильных оснований [CH3COONa, NaClO, KNO2, Na2CO3, Na3PO4]
CH3COONa + HOH «CH3COOH + NaOH
CH3COO- + НОН «CH3COOН + OH-, рН > 7
Анионы слабых кислот выполняют функцию оснований по отношению к воде – донору протонов, что приводит к увеличению концентрации ОН-, т.е. подщелачиванию среды.
Глубина протекания гидролиза определяется: степенью гидролиза aг:
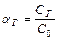 ,
,
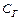 – концентрация соли, подвергшейся гидролизу
– концентрация соли, подвергшейся гидролизу
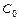 – концентрация исходной соли
– концентрация исходной соли
aг невелика, например, для 0,1 моля раствора CH3COONa при 298 К она равна 10-4.
При гидролизе в системе устанавливается равновесие, характеризующееся Кр
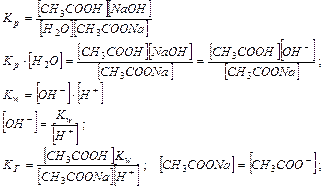
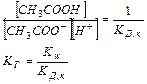
Следовательно, чем меньше константа диссоциации, тем больше константа гидролиза. Степень гидролиза с константой гидролиза связана уравнением:
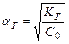 .
.
С увеличением разбавления, т.е. уменьшением С0, степень гидролиза увеличивается.
2. 2.Соль, образованная катионом слабых оснований и анионом сильных кислот [NH4Cl, AgNO3, ZnCl2, Fe2(SO4)3]
NH4Cl + HOH ↔ NH4OH +
HCl
NH4+ + HOH ↔ NH4OH + H+, pH < 7
Протолитическое равновесие смещено влево, катион слабого основания NH4+ выполняет функцию кислоты по отношению к воде, что приводит к подкислению среды. Константа гидролиза определяется по уравнению:
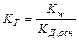
Равновесная концентрация ионов водорода может быть вычислена: [Н+]равн = aг × С0 (исходная концентрация соли), где
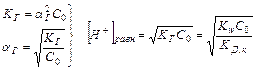 ;
;
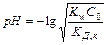
Кислотность среды зависит от исходной концентрации солей подобного вида.
3. 3.Соль, образованная анионом слабых кислот и катионом слабых оснований. Гидролизуется и по катиону и по аниону [NH4CN, CH3COONH4, (NH4)2S, (NH4)2CO3, (NH4)3PO4, ZnS, AlPO4, Al(CH3COO)3, C4(HCOO)2]
NH4CN + HOH à NH4OH + HCN
Для определения рН среды раствора сравнивают КД,к и КД,осн
КД,к > КД,осн à среда слабо кислая
КД,к < КД,осн à среда слабо щелочная
КД,к = КД,осн à среда нейтральная

Следовательно, степень гидролиза этого вида солей не зависит от их концентрации в растворе.
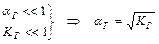
т.к. [H+] и [ОН-] определяются КД,к и КД,осн, то 
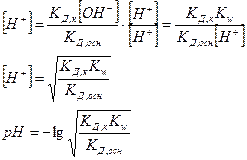
рН раствора также не зависит от концентраций соли в растворе.
Соли, образованные многозарядным анионом и однозарядным катионом (сульфиды, карбонаты, фосфаты аммония) практически полностью гидролизуются по первой ступени, т.е. находятся в растворе в виде смеси слабого основания NH4OH и его соли NH4HS, т.е. в виде аммонийного буфера.
Для солей, образованных многозарядным катионом и однозарядным анионом (ацетаты, формиаты Al, Mg, Fe, Cu) гидролиз усиливается при нагревании и приводит к образованию основных солей.
Гидролиз нитратов, гипохлоритов, гипобромитов Al, Mg, Fe, Cu протекает полностью и необратимо, т.е. соли не выделены из растворов.
Соли: ZnS, AlPO4, FeCO3 и др. в воде малорастворимы, тем не менее часть их ионов принимает участие в процессе гидролиза, это приводит к некоторому возрастанию их растворимости.
Сульфиды хрома и алюминия гидролизуются полностью и необратимо с образованием соответствующих гидроксидов.
4. 4.Соли, образованные анионом сильных кислот и сильных оснований гидролизу не подвергаются [KCl, Na2SO4, Ba(NO3)2].
Чаще всего гидролиз ‑ вредное явление, вызывающее различные осложнения. Так при синтезе неорганических веществ из водных растворов в получаемом веществе появляются примеси – продукты его гидролиза. Некоторые соединения из-за необратимо протекающего гидролиза вообще не удается синтезировать.
·-если гидролиз протекает по аниону, то в раствор добавляют избыток щелочи
·-если гидролиз протекает по катиону, то в раствор добавляют избыток кислоты
Итак, первая качественная теория растворов электролитов была высказана Аррениусом (1883 – 1887 г.). По этой теории:
1. 1.Молекулы электролита диссоциируют на противоположные ионы
2. 2.Между процессами диссоциации и рекомбинации устанавливается динамическое равновесие, которое характеризуется КД. Это равновесие подчиняется закону действия масс. Долю распавшихся молекул характеризует степень диссоциации a. КД и a связывает закон Оствальда.
3. 3.Раствор электролита (по Аррениусу) – это смесь молекул электролита, его ионов и молекул растворителя, между которыми отсутствует взаимодействие.
Вывод: теория Аррениуса позволила объяснить многие свойства растворов слабых электролитов при небольшой концентрации.
Однако, теория Аррениуса носила только физический характер, т.е. не рассматривала вопросы:
· По какой причине вещества в растворах распадаются на ионы?
· Что происходит с ионами в растворах?
Дальнейшее развитие теория Аррениуса получила в работах Оствальда, Писаржевского, Каблукова, Нернста и т.д. Например, на важное значение гидратации впервые указал Каблуков (1891), положив начало развитию теории электролитов в направлении, которое указывал Менделеев (т.е. ему впервые удалось объединить сольватную теорию Менделеева с физической теорией Аррениуса). Сольватация – это процесс взаимодействия электролита
молекулами растворителя с образованием комплексных соединений сольватов. Если растворителем является вода, следовательно, процесс взаимодействия электролита с молекулами воды называется гидратацией, а аквакомплексы – кристаллогидратами.
Рассмотрим пример диссоциации электролитов, находящихся в кристаллическом состоянии. Этот процесс возможно представить в две стадии:
1. 1.разрушение кристаллической решетки вещества DН0кр > 0, процесс образования молекул (эндотермический)
2. 2.образование сольватированных молекул, DН0сольв < 0, процесс экзотермический
Результирующая теплота растворения равна сумме теплот двух стадий DН0раств = DН0кр + DН0сольв и может быть как отрицательной, так и положительной. Например, энергия кристаллической решетки KCl = 170 ккал/моль.
Теплота гидратации ионов К+ = 81 ккал/моль, Cl- = 84 ккал/моль, а результирующая энергия равна 165 ккал/моль.
Теплота гидратации частично покрывает энергию необходимую для выделения ионов из кристалла. Оставшиеся 170 - 165 = 5 ккал/моль могут быть покрыты за счет энергии теплового движения, и растворение сопровождается поглощением теплоты из окружающей среды. Гидраты или сольваты облегчают эндотермический процесс диссоциации, затрудняя рекомбинацию.
А вот ситуация, когда присутствует только одна из двух названных стадий:
1.растворение газов – нет первой стадии разрушения кристаллической решетки, остается экзотермическая сольватация, следовательно растворение газов, как правило, экзотермично.
2.при растворении кристаллогидратов отсутствует стадия сольватации, остается лишь эндотермическое разрушение кристаллической решетки. Например, раствор кристаллогидрата: CuSO4 × 5H2O (т) à CuSO4 × 5H2O (р)
DНраств = DНкр = + 11,7 кДж/моль
Раствор безводной соли: CuSO4 (т) à CuSO4 (р) à CuSO4 × 5H2O (р)
DНраств =DНсольв + DНкр = - 78,2 + 11,7 = - 66,5 кДж/моль
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1078; Нарушение авторских прав?; Мы поможем в написании вашей работы!