
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кр – это отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, в степенях их стехиометрических коэффициентов
|
|
|
|
Химическое равновесие.
Когда при химическом взаимодействии хотя бы одно из исходных веществ расходуется полностью, реакцию считают необратимой, протекающей до конца. Например, разложение бертолетовой соли:
KClO3 ® KCl+ 1,5 O2. Многие химические реакции протекают обратимо. Их особенность состоит в том, что они идут не до конца, в системе всегда остается (в большем или меньшем количестве) каждое из исходных веществ. К числу обратимых реакций относится, например: СО(Г) + Н2О(Г) = СО2(Г) + Н2(Г). Реакцию, протекающую в правую сторону, называют прямой,, а в левую – обратной. Если 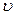 прям =
прям = 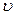 обр, состояние системы называют химическим равновесием, его характеризуют константой равновесия Кр.
обр, состояние системы называют химическим равновесием, его характеризуют константой равновесия Кр.
Для гомогенных реакций:
aA(г) + bB(г) Û cC(г) + dD(г), 3Н2+N2Û2NH3
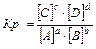 ,
, 
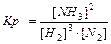
Для гетерогенных реакций:
aA(т) + bB(Г) = cC(Г) + dD(Г), C(т)+ O2(Г) = СО2(Г)
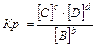
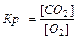
Константа равновесия зависит от природы веществ, температуры. Присутствие катализатора в системе не влияет на значение КР, поскольку он снижает ЕА прямой и обратной реакций на одну и ту же величину и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, он не влияет на количественный выход продуктов реакции. КР не зависит от концентрации реагирующих веществ.
Химическое равновесие является подвижным (динамическим), его можно смещать, изменяя различные факторы (С; Р; T). Сдвиг химического равновесия определяется принципом Ле-Шателье:
если на систему, находящуюся в равновесии оказывать внешнее воздействие, то система противодействует этому воздействию, стараясь его уменьшить.
Задача.
В каком направлении произойдет смещение химического равновесия системы: N2(г) + 3H2(г) 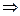 2NH3(г), ΔΗ‹ 0 – (реакция экзотермическая).
2NH3(г), ΔΗ‹ 0 – (реакция экзотермическая).
Реакция идет в прямом Реакция идет в обратном
направлении направлении


если понизить температуру t0С, если повысить t0C
увеличить давлние P уменьшить Р
увеличить концентрации  увеличить
увеличить 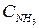
уменьшать 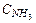 т.е.отводить NH3,
т.е.отводить NH3,
Задача. В гомогенной системе СО + Сl2 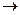 COCl2, равновесные концентрации
COCl2, равновесные концентрации  Вычислите Кр и исходные концентрации.
Вычислите Кр и исходные концентрации.
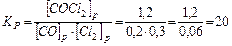 .
.
В результате реакции образовалось 1,2 моля СОСl2, учитывая коэффициенты в уравнении реакции, израсходовалось 1,2 моль/л СО и 1,2 моль/л Сl2, а так как к моменту равновесия осталось 0,2 моль/л СО и 0,3 моль/л Сl2, то

Рассматривая законы химической термодинамики, было установлено, что возможно протекание тех процессов, у которых ΔG0298<0 (Р, Т = const), а т.к. при химическом равновесии идут обратимые процессы, то какой именно процесс будет преобладать, можно определить по изменению энергии Гиббса. Мы знаем, что равновесие зависит не только от концентрации, но и от температуры и давления (для газообразных систем).
Зависимость Кр. от температуры при постоянном давлении связана с изменением ΔG0298 уравнением:
ΔG0298 = -2,3 RT lg Kр, если R = 8,31·10-3 кДж/моль·К; T = 298 K ΔG0298 = -5,7 lg Kр, кДж/моль.
Если lgKр > 0, т.е. Кр > 1, тогда ΔG0298 < 0 равновесие смещается в сторону прямой реакции.
Если lgKр < 0, т.е. Кр < 1, тогда ΔG0298 > 0 равновесие смещается в сторону обратной реакции.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 636; Нарушение авторских прав?; Мы поможем в написании вашей работы!