
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости химической реакции от катализатора
|
|
|
|
Катализатор – это вещество, изменяющее скорость химической реакции, количество которого в результате реакции остается неизменным. Изменение скорости химической реакции в присутствии катализаторов называется катализом. Реакции, скорость которых можно изменить при помощи катализаторов, называются каталитическими. Катализаторы, замедляющие скорость химической реакции, называются ингибиторами. Например, тетраэтилсвинец Pb(C2H5)4 – противодействует детонации топлива в двигателях внутреннего сгорания. Вещества, усиливающие действие катализатора называются промоторами. Вещества, подавляющие действие катализатора называются каталитическими ядами; биологические катализаторы называются ферментами.
Механизм катализа может быть различным. По теории промежуточных соединений катализатор (К) с одним из реагирующих веществ (А) образует промежуточное соединение АК (активированный комплекс) с более низким значением энергии активации, способное к более эффективному взаимодействию с другим веществом (В).
А + В 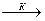 АВ
АВ
А + К 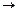 АК
АК
АК + В  АВ + К
АВ + К
Таким образом, катализатор разбивает реакцию на промежуточные стадии; при этом образуется ряд неустойчивых промежуточных соединений – активированных комплексов. Например, самопроизвольный процесс разложения пероксида водорода идет медленно: Н2О2  Н2О + 1/2О2 Еа = 75 кДж/моль.Использование катализатора MnO2 увеличивает скорость реакции (Еа = 49 кДж/моль), за счет образования активированного комплекса MnO3 :
Н2О + 1/2О2 Еа = 75 кДж/моль.Использование катализатора MnO2 увеличивает скорость реакции (Еа = 49 кДж/моль), за счет образования активированного комплекса MnO3 :
Н2О2 + MnO2  H2O + MnO3
H2O + MnO3
 MnO3
MnO3 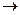 MnO2+ 1/2O2 H2O2 + MnO2
MnO2+ 1/2O2 H2O2 + MnO2 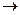 H2O + MnO2 + 1/2O2
H2O + MnO2 + 1/2O2
Катализатор снижает энергию активации, разбивая реакцию на ряд промежуточных стадий.
Катализатор может быть специфичен для однотипных реакций, например, V2O5 ускоряет реакции окисления SO2, NH3 и т.д. Он может быть и универсален, т.е. может изменять скорости разных реакций, например,
2SO2 + O2 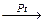 2SO3; CH2 = CH2 + H2
2SO3; CH2 = CH2 + H2 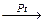 CH3 – CH3. Катализатор может изменять не только скорость химической реакции, но и ее механизм.
CH3 – CH3. Катализатор может изменять не только скорость химической реакции, но и ее механизм.
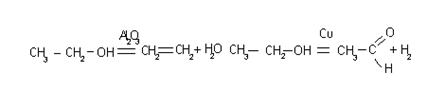
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!