
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Смешанные комплексы
|
|
|
|
Циклические КС (хелаты).
КС, содержащие лиганды ионного типа
КС, содержащие лиганды молекулярного типа
- аммиакаты: [Cu(NH3)4](OH)2; [Pt(NH3)4]Cl2
-аквакомплексы: [Cr(H2O)6]Cl3; [Cu2(H2O)4]SO4 - - карбонилы металлов: [Fe(CO)5]; [Ni(CO)4].
- гидроксокомплексы: Na2[Zn(OH)4]; K3[Al(OH)6]
- ацидокомплексы:K3[Fe(CN)6]; Na3[AlF6] K2[HgI4]
-двойные соли: CuCl2 · KCl; KCl · MgCl2
К наиболее важным циклическим КС относятся хелаты или клешнеобразные соединения, в которых ЦА и полидентатный лиганд образуют цикл. Например, в реакции Си (ОН)2 с аминоуксусной кислотой образуется нейтральный комплекс – меди(II) глицинат: 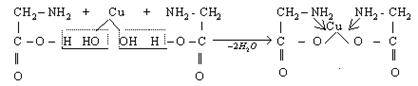 ЦА меди связан с азотом аминогруппы по донорно-акцепторному механизму, а с кислородом карбоксильной группы обычной ковалентной связью.
ЦА меди связан с азотом аминогруппы по донорно-акцепторному механизму, а с кислородом карбоксильной группы обычной ковалентной связью.
[Cr (H2O)5Cl]Cl2 [Co (NH3) 3(NO2)3]
Номенклатура комплексных соединений.
В настоящее время единый подход к решению вопроса о номенклатуре КС отсутствует. Украинские ученые предлагают:
1. в названиях КС первым указывать катион, вторым - анион.
2. в названиях комплексных ионов или молекул лиганды перечислять в алфавитном порядке независимо от заряда. Анионным лигандам приписывать окончание «о», нейтральные лиганды называть, как соответствующие молекулы, за исключением H2O-аква, NH3-аммин. Количество лигандов обозначать численными приставками: ди -; три -; тетра -; пента -; гекса - и т.д..
3.В названиях комплексных анионов комплексообразователю присваивать суффикс – «ат».
4.Степень окисления Ц.А. указывать в скобках римскими цифрами. Например:
[Co(NH3)5Cl]Cl2- пентаамминхлорокобальта (IV) хлорид
K4[Fe(CN)6]-калия гексацианоферрат (II)
[Mo6(H2O)6Cl8]Cl4- гексаакваоктахлорогексамолибдена (II) хлорид
В процессе образования КС по донорно-акцепторному механизму орбитали ЦА претерпевают гибридизацию. Тип гибридизации орбиталей комплексообразователя определяет геометрию комплексного иона. Например,
Таблица № 17
| № п/п | Ионы Ме | КЧ | Вид гибридизации акцепторных орбиталей | Геометрическая конфигурация | Пример |
Agº(4d¹º5s¹)  Ag+(4d105s0)
Ag+(4d105s0)
| sp-гибридизация
NH3 NH3

| Линейная | [Ag(NH3)2]+ диамагнитный | ||
Zn0(3d104s2)  Zn2+(3d104s04p0)
Zn2+(3d104s04p0)
| sp3-гибридизация
NH3 NH3 NH3 NH3
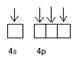
| Тетраэдр | [Zn(NH3)4] ² + диамагнит-ный | ||
Ni0 (3d84s2)  Ni2+(3d84s0)
Ni2+(3d84s0)
| dsp2-гибридизация
CN-CN- CN- CN-
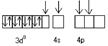
| квадрат | [Ni(CN)4]² ‾ диамагнит-ный | ||
Ni0  Ni2+ Ni2+
| sp3-гибридизация
C1- C1- C1- C1-
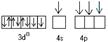
| тетраэдр | [NiCl4] ² ‾ парамагнитный | ||
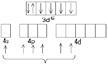
Co0(3d74s2)  Co3+(3d64s0)
Co3+(3d64s0)
| 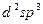 - гибридизация
6NH3 - гибридизация
6NH3

| октаэдр | [Co(NH3)6]³ + диамагнит-ный | ||
Co0  Co3+ Co3+
| 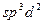 гибридизация гибридизация
 6F‾
6F‾
| октаэдр | [CoF6] ³‾ парамагнит-ный |
Различия в магнитных свойствах веществ могут быть объяснены электронным строением их атомов, ионов и молекул. Диамагнитными (немагнитными) считаются частицы, суммарный магнитный момент которых равен нулю, т.е. все электроны спарены и их магнитные моменты взаимно компенсируются. Если частица имеет один или несколько неспаренных электронов, то суммарный магнитный момент отличен от нуля, такая частица является парамагнитной.
Свойства КС зависят также от природы L. По силе воздействия на валентные электроны ЦА лиганды располагают в спектрохимический ряд:
 CO>CN->NO2->NH3>CNS->H2O>OH->F->Cl->Br-->I-
CO>CN->NO2->NH3>CNS->H2O>OH->F->Cl->Br-->I-
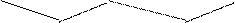 |
L сильного поля L поля средней силы L слабого поля
В случае сильного поля лигандов образуются спин-спаренные КС (табл. 2, соед. 3;5),а в случае слабого поля – спин-свободные КС (табл. 2, соед 4;6) Многие КС имеют окраску. Это объясняется возможностью перехода электронов с одного d-энергетического подуровня на другой при наличии незаполненных орбиталей. При поглощении веществами определенной части спектра само вещество оказывается окрашенным в дополнительный цвет. Например, почему соединения Au(I) не окрашены, а Au(III) окрашены? Ион Au+ имеет электронную конфигурацию 5d10. Все 5d-орбиталей заполнены, переход электронов на d-подуровень невозможен. У иона Au3+ 5d8-электронов, следовательно, на d-уровне две вакансии, переход электронов в пределах d-подуровня возможен, поэтому соединения Au3+ окрашены.
Ионы внешней сферы связаны с комплексным ионом силами электростатического взаимодействия, поэтому в растворах КС диссоциируют подобно сильным электролитам на внутреннюю и внешнюю сферы (первичная диссоциация). Например:
K3[Fe(CN)6] ↔ 3K+ + [Fe(CN)6]3- добавляя к раствору комплексного соединенияK3[Fe(CN)6] роданид калияKCNS красный цвет, характерный для соединения Fe(CNS)3 не появляется.
[Аg (NH3) 2] Cl ↔ [Ag (NH3) 2]+ + Cl-
Если КС является нейтральной частицей, то ей не присуща первичная диссоциация.
Комплексный ион диссоциирует значительно слабее (подобно слабым электролитам)– это вторичная диссоциация, она может идти ступенчато и характеризуется КД, которая называется константой нестойкости (Кнест).
[Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3I ступень, К нест 1
+
[Ag(NH3)]+ ↔ Ag+ + NH3 II ступень, К нест 2
[Ag(NH3)2]+ → Ag+ + 2NH3, К нест=Кнест1 . К нест2
Эта величина является мерой устойчивости комплексного иона. Чем меньше значение Кнест, тем прочнее комплексный ион. Например, из комплексных ионов [Fe(CN)6]3- (Кнест= = 1,0 . 10-44), [Fe(CN)6]4-(Кнест =1,0. 10-37) и [Ag(NH3)2]+(Кнест= = 2,8. 10-8) - самым прочным являетя комплексный ион гексацианоферрата [Fe(CN)6]3-.
Для получения КС можно использовать реакции соединения, замещения, двойного обмена, окислительно-восстановительные реакции (ОВР).
1) реакции соединения
CuCl2 + 4H2O → [Cu (H2O) 4] Cl2
Cr (OH) 3 + 3NaOH → Na3 [Cr (OH) 6]
Cерозеленый зеленый
3KCN + Fe (CN) 3 → K3 [Fe (CN) 6]
2) реакции внешнесферного обмена
3Fe2+SO4 + 2K3[Fe3+(CN) 6] → Fe3 [Fe (CN) 6]2↓ + 3K2SO4
синий
3) реакции внутрисферного обмена
[Co (H2O) 4] Cl2 + 4KCNS → K2 [Co (CNS) 4] + 2KCl + 4H2O
розовый фиолетовый
4) окислительно-восстановительные реакции
2K4[Fe2+(CN) 6] + Cl2 → 2K3[Fe3+(CN)6] + 2KCl
Разрушение комплексных соединений можно осуществлять нагреванием, разбавлением, связыванием лигандов в более прочные соединения.
[Cu (NH3) 4](OH) 2 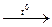 CuO + H2O + 4NH3↑
CuO + H2O + 4NH3↑
K2 [Co (CNS) 4] + 4H2O → [Co (H2O) 4](CNS) 2 + 2KCNS
[Ag (NH3) 2] Cl + 2HNO3(Kонц) → AgCl↓ +2 NH4NO3
[Cu (NH3) 4](OH) 2 + Na2S → CuS↓ + 4NH3↑ + 2NaOH
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!