
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ. Реакторлар 3 страница
|
|
|
|
= (п + 3) Н3РО4 + CaSO4 · m H2O + HF
жазуға қолайлы болу үшін және қысқартылған түрінде фторапатит қос тұзының формуласы 3Са3(РО4)2 · СаҒ2 - Са5(РО4)зҒ түрінде жазылады.
Түзілген фосфор қышқылының бір бөлігі процеске кері қайтады. Фосфор қышқылының концентрациясына және температураға байланысты, түзілген кальций сульфаты - ангидрит (m = 0), жартылайгидрит (m = 0,5) және дигидрат (m = 2) түрінде тұнбаға түседі. Осыған байланысты фосфор қышқылын экстрациялық әдіспен өндірудің 3 нұсқасы ажыратылады: ангидритті, жартыгидратты және дигидратты. Фторапатиттің әр нұсқада ыдырау шарттары 5.11 кестеде көрсетілген.
Температуралық режим әр нұсқадағы экстракциялық процеске тәуелді. Дигидратты әдісте - температура 70 - 80°С - та, реакциялық қоспадағы қышқыл концентрациясы 20-32 % Р2О5 болғанда гидратты кальций сульфаты - дигидрат түрінде тұнбаға түседі, ал жартыгидратты әдісте - температура 90-100°С, қышқыл концентрациясы 35-42 % Р2О5 болғанда жартыгидрат түрінде тұнбаға түседі. Кальций сульфатының кристалдану формасы фосфор қышқылының (Р2О5) концентрациясына және температурасына тәуелділігі 5.6 суретте көрсетілген. 2 - кальций сульфатының дигидрат түрінде кристалдануы, 1 - ангидрит түрде.

Сурет 5.6. Кальций сульфатының критсаллдануына қышқыл концентрациясының және температураның әсері.
Кесте 5.11 Фторапатиттің ыдырау шарты.
| Процесстің түрі | Температура С | Сұйық фазадағы концентрация Р2О5 % | Реакция жылуы кДж / моль |
| Дигидратты | 70-80 | 25-32 | 384,4 |
| Жартылайгидратты | 90-100, | 35-42 | 371,0 |
Фторапатитті қышқыл қатысында ыдыратқанда бөлінетін фторлы сутектің бір бөлігі атмосфераға таралады және кремний қышқылымен реакцияға түседі:
H2SiO3 + 6HF = H2SiF6 + 3Н2О
Түзілген кремний фторсутек қышқылы біртіндеп ыдырайды және газды фазаға тетрафторсилан бөлінеді:
2H2SiF6 + H2SiO3 = 3SiF4 + 3Н2О
Сонымен бірге тетрафторсилан мен фторсутек әрекеттесіп -кремнийфторлы сутек қышқылы түзіледі:
SiF4 + 2HF = H2SiF6
Фторлы қосылыстардың газды фазаға бөлінуі жоғары температурада өтеді. Фторапатиттің қышқылмен ыдырау жылдамдығын, қарапайым гетерогенді процестегі тенлікпен көрсетуге болады:
u = km·f· ac (5.6)
Ол температура жоғарылағанда және шикізаттың реагентпен араласу интенсивтілігіне байланысты өседі.
Фосфаттың қышқылмен ыдырау жылдамдығы күкірт қышқылының концентрациясына тәуелді (сурет 5.7). Оған химиялық реакцияның жылдамдығы ғана тәуелді емес, сонымен қатар, фосфаттың беткі бөлігіне, тұнбаға түсетін кальций сульфат кристалдарының құрылымы және қышқылдың қатты фазадағы диффузиялану жылдамдығы да тәуелді.

Сурет 5.7. Фосфат ыдырау сатысының қышқыл концентрациясына тәуелділігі.
Төмен концентрлі қышкылда диффузияға ұшырамайтын, ірі кристалдар түзіледі. Сондыктан процестің жылдамдығы және ыдырау сатысы - күкірт кышқылының бастапкы концентрациясының қасиетіне байланысты.
Максимум 1 - де фосфаттың төмен концентрлі қышқылмен ыдырау жылдамдығы жоғары. Бірак кышкылмен бірге көп мөлшерде бөлінетін су өнімнің кристалдануына кедергі жасайды. Максимум 2 - де реакциялық қоспадағы кышкылдың концентрациясы 5—10% болғанда ыдырау жылдамдығы сұйық және катты фазаның 3: 1 қатынасы кезінде артады. Фосфаттың жоғары сатыда ыдырауы - 0,99 үлеске тең, ол 1 - 1,5 сағат уақытта жүреді. Экстракцияның практикалық процесі 4-8 сағатқа дейін жалғасады. Бұл фосфор қышқылынан оңай шайылып, фильтрленетін ірі кристалдардың түзілуіне өте қажет.
Өндірістің технологиялық принципті сызбасы. Экстракциялық фосфор қышқылын дигидратты және жартыгидратты әдіспен алуға болады. Бірақ жартыгидратты әдіс арқылы шикізатты үнемдеуге және аппараттарды жоғары интенсивті өнім өндіруге, сонымен қатар жоғары концентрлі қышқыл алуға болады. Экстрациялық фосфор кышқылын бір сатыда жартыгидратты әдіспен өндірудің принципі 5.8 суретте, ал технологиялық сызбанұсқасы 5.9 суретте көрсетілген.
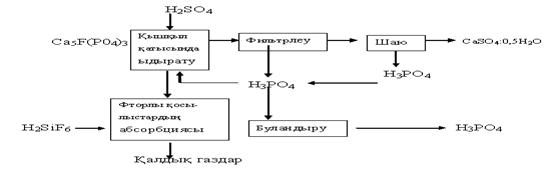
Сурет 5.8 Экстракциялық фосфор қышқылын өндірудің принциптік сызнұсқасы.
Күкірт қышқылы мен фосфор қышқылының айналымдағы ерітінділерінің қоспасы жинағыштан (2) және фосфатты бункерден (1) көпсекциялы экстракторға (3) беріледі. Пульпаның жылжу шамасы бойынша экстракторда фосфор қышқылы түзіледі және кальций сульфатының кристалдану процесі аяқталады. Пульпа экстракторының соңғы секциясынан үшсекциялы вакуум-фильтрге түседі. Фильтрдің бірінші секциясындағы негізгі фильтрат Ф-1 фосфор қышқылы өнімі болады, оның бір бөлігі қышқыл жинағының кері ерітіндіге бағытталған бөлігіне қосылады. Фильтрдегі кальцийдің тұнбасы ыстық судың кері тогымен тазаланады, сонымен қатар шайылған ерітінді Ф-3 – фильтрдің екінші секциясында бірінші тазалағыш ретінде қолданылады. Бірінші тазалағыш Ф-2 – фильтраты айналымдағы ерітінді ретінде жинаққа бағытталады.

Cурет 5.9 Экстракциялық фосфор қышқылын жартыгидратты әдіспен өндірудің технологиялық сызбанұсқасы.
1 – фосфат бункері, 2 – күкірт қышқыл жинағы, 3 – экстрактор, 4 – вакум фильтр, 5 – фосфор қышқылын жылытқыш, 6 – концентратор, 7 – тазалағыш скруббер, 8 – тазалағыш сұйықтықтың жинағы.
2. Түзілген фосфор қышқылын (Ф-1), қыздырғышта 5 бумен қызады және берілген концентрацияға дейін оттық газдармен тікелей қатынасқа түсіп, буланады да, қоймаға бағытталады. Концентратордан бөлінген газдар фтор қоспасын жинайтын және атмосфераға тастайтын тазалағыш скрубберге 7 өтеді. Экстрактордан бөлінетін газдар және құрамында фторсутек және тетрафторсилан бар қоспалар сұйық кремнийфторсутек қышқылымен суарылатын абсорберге беріледі. Экстракциялық қышқылды өндірудегі негізгі аппараттарға – экстрактор және вакуум-фильтрі жатады. Экстрактор бұл 10 секцияға бөлінген араластырғышы бар, пульпа 1 секциядан келесіге бір қалыпты ағатын – темір тік бұрышты қима бетон. Басқа да нұсқаларында экстрактор араластырғышы бар біріктірілген 2 цилиндрден тұрады. Экстрактордың 730 м3 жұмыс істеу көлемінде Р2О5-тің интенсивтілік шамасы 25 кг/м3 сағ болған кезде өндіру жылдамдығы 340 т/тәулігіне жетеді.
Тартпа және ленталық вакуум – фильтрлер қолданылады. Қайықшалы сүзгілер 24 - қайықшадан тұрады. Олардың әрқайсысы фильтр іске қосылғанда филтр аймағынан, пульпа және кальций сульфатының жуындысынан өтеді. Фильтр бетінің ауданы 80-160 м2 құрайды. Лента қозғалғанда 3 вакуум – камерасымен қосылады да соған сәйкес негізгі сүзінді (қышқыл өнімі), бірінші және екінші жуғыш фильраттар жиналады. Фосфор қышқылының жартыгидратты әдіспен өндірудегі іске қосылған қондырғылардың өнімділігі – жылына 350 000 және төмендегі параметрлермен сипатталады:
- процестің температурасы 80-1000С;
- сұйық фазаның қатты фазаға қатынасы 2,5:1;
- күкірт қышқылының бастапқы концентрациясы – 0,75 мас.бөлігі.
- экстракция дәрежесі– 0,98 үлеске тең.
- Фосфор қышқылы өнімінің концентрациясы Р2О5 бойынша – 0,45 үлеске тең.
Фосфор қышқылын экстракциялық әдіспен өндірудің барлық нұсқасында ортақ кемшіліктер бар.
- Минералды тыңайтқыштар өндірісіне қажетті – фосфор қышқылы концентрациясын буландыру арқылы алады.
- Концентрлеу сатысындағы аппараттардың қатты жемірілуі коррозиясы).
- Кальций сульфатының кристалдары және кремний қышқыл қалдықтарының аппарат қабырғасына жиналуы.
Электротермиялық әдіспен фосфор қышқылын өндіру. Процестің физика-химиялық негіздері. Фосфор қышқылы өндірісінің электротермиялық әдісі элементарлы фосфорға дейін фосфатты қайта қалпына келтіруге, фосфор оксидіне дейін оны кезекті тотықтыруға, және фосфор қышқылына дейінгі оксидті гидратациялауға негізделген:

1.Фосфордың алынуы. Табиғи фрсфаттардан фосфорды тотықсыздандыру бұл көп сатыларда жүретін күрделі де көп сатылы гетерогенді процесс:
- шихтаның компоненттерін қыздыру;
- фосфат балқымасына кальций мен кремний оксидінің келіп түсуі;
-Үшкальцийфосфатты диссоциациялау;
- көміртек бөліктері бетіне диссоциация өнімдерінің диффузиясы;
- үшкальций фосфаттың көміртегімен өзара әсерлесуі және фосфор, көміртегі (II) оксиді және кальций оксидінің түзілуі;
- реакция зонасынан кальций оксидін кальций силикаты түрінде шығару.
Флюстар қатыспаған жағдайда тотықсыздану реакциясы 1400°С -де 20 минут уақыт аралығында өтеді. Процесс температурасын төмендету және реакция біркелкілігін оңға ығыстыру үшін жүйе түзілетін кальций оксидін жеңіл шығарылатын шлак ретінде байланыстыратын кремний оксидін, алюминий оксидін және алюмосиликаттарды енгізеді:
2Ca5(PO4)3F+15C+6SiO2=3P2+15CO+3(3CaO-SiO2)+CaF2+DH, DН=1730 кДж
Ал, флюстар қатысқан жағдайда тотықсыздану реакциясы жеткілікті жоғары жылдамдықта 1100-1300° С температура өтеді. Балқыма қозғалғыштығын жоғарылату мен шлактардың түзілуін жеңілдету үшін тотықсыздану реакциясын тәжірибеде 15000С кезінде жүргізеді.
2. Фосфорды жағу - бұл мына теңдік бойынша жүретін гетерогенді экзотермиялық процесс:
P4с + 5O2г = P4O10 қат – DН DH=753 кДж
Ол фосфор диоксиді (V) димері арқылы жүреді. Фосфордың тотығу дәрежесі жану зонасындағы температураға және сұйық фосфор бетіне оттегінің диффизиялық жылдамдығына тәуелді.
Жану толық жүруі үшін және төменгі фосфор оксидінің түзілу мүмкіндігін жою үшін процесті 1000-1400°С температурада және ауаның екі есе артықшылығында жүргізеді.
3. Фосфор оксидінің (V) гидратациясы бірқатар сатылар арқылы жүреді. Процестің бірінші сатысында, жоғары температура салдарынан жүйеде фосфор оксиді буының сумен өзара әсері метафосфор қышқылын береді:
Р4О10 + 2Н2О = 4НРО3 - DН
Температураны төмендеткен кезде метафосфор қышқылдары арқылы фосфор (ортофосфор қышқылы) қышқылына айналады:
HPO3+H2O=H3PO4-DH
Өндірудің технологиялық сызбасы. Электротермиялық әдіспен фосфор қышқылы өндірісінің технологиялық процесі екі варианттан тұрады.

Сурет 5.10 Термиялық әдіспен фосфор қышқылын өндірудің технологиялық үлгісі. екі сатылы; бір сатылы.
- бір сатылы сызба бойынша, ол кезде фосфор буын алдын-ала конденсацияламай, фосфор құрамды газды жағу;
- екі сатылы үлгі бойынша, яғни фосфор буын алдын-ала конденсациялау және оны фосфор қышқылына кезекті өңдеу; Фосфордың тотығуымен фосфор (V) оксидінің гидратациялануы кезеңінде көп мөлшерде жылу бөлінеді, оны процестің оптималды жылулық режимін ұстап тұру үшін жүйеден шығару керек. Термиялық фосфор қышқылының өндірісінде қондырма жылулығын шығару әдісі бұландыру, циркуляциялық және жылуалмасушылық болып бөлінеді. Олардың ерекшеліктері мен сипаттамалары келесі үлгіде келтірілген.
Барынша кең таралған циркуляциялы - буландыру үлгісі болып табылады, онда газдардың суытылуы циркуляциялық фосфор қышқылының жылуалмасуы мен нәтижесінде одан судың булануы есебінде жүреді. Мұндай қондырманың өнімділігі 100%-тік қышқыл 2,5 т/сағ. Жанатын фосфор бойынша жылына 60 мың т. болады. Суреті 5.10 суретте келтірілген.
Циркуляцияланатын фосфор қышқылының жану процесін суытуға және гидратацияға шығыны: жану мұнарасында 500-750 м3/сағ, ал гидратациялау мұнарасында 150 м3/сағ. құрайды. Өздігінен күйдірілетін аноды (1) бар үш фазалы (2) шихта беріледі, шихта құрамы фосфат, кремний оксиды (кварцит) және кокс. Пештен құрамында 6-10% фосфор бар газ газбөлгіш (3) арқылы электрофильтрге (4) келеді. Тазаланған ыстық газ ыстық (5) және салқын (6) конденсатор – жуғышқа беріледі. Сұйыққа айналған фосфор (0,995) жинағышқа 7.8 және тұнбалағышқа (9) келеді. Тұнбалағыштан (9) фосфор мен ауа жағу мұнарасына (10) беріледі, ауада фосфор жанады. Мұнарадағы газды циркуляциялық фосфор қышқылымен салқындатады. Ыстық фосфор қышқылы мұздатқышта (11) суытылады, оның бір бөлігі 75%-тік қышқыл ретінде тауарлы өнім қоймаға жіберіледі. Электропештен шыққан қалдық газ құрамындағы СО ауада жағылады, ыстық шлакты сумен суыту арқылы фосфошлак (кальций силикаты), ал темірлі балқымадан – феррофосфор өндіреді. Фосфорды жағу және гидратация жүйелеріндегі циркуляциялық фосфор қышқылының шығыны:
- жағу мұнарасында 500 – 750 м3/сағ;
- гидратация мұнарасында 150 м3/сағ.
Термиялық фосфор қышқылы өндірісінде негізгі аппараттар жану мұнарасы мен гидратация мұнарасы болып табылады.
Жану мұнарасы конусты формаға ие, диаметрі шамамен 4м және ұзындығы (биіктігі) 14м. Мұнара қақпағы сумен суытылады және фосфор шашуға арналған форсункасы бар.
Ал, гидратациялау мұнарасы цилиндр түрінде жасап шығарылған, диаметрі 3м, ал биіктігі 15м. Рашиг сахиналары салынған. Қышқылды шашырату үшін форсункалардың үш бөлігіне ие.

Сурет 5.10 Термиялық өндірістегі фосфор қышқылының 2 әдіспен алудың технологиялық сызбанұсқасы.
1-электр пеші; 2-шихта бункері; 3-газ бөлгіш; 4,14-электросүзгіш; 5-ыстық конденсатор; 6-суық конденсатор; 7,8-сұйық фосфорды жинағыш; 9-сұйық фосфорды тұнбалағыш; 10-жану мұнарасы.
Фосфор қышқылы өндірісінің электротермиялық әдісі экстракциялы әдіспен салыстырғанда бірқатар артықшылықтарға ие:
- 115% Р2О5 дейінгі концентрациядағы полифосфор қышқылын қосқандағы, жоғары концентрацияда қышқыл алу мүмкіндігі;
- өнімнің жоғары тазалығы;
- фосфатты шикізат фосфордың төменгі концентрациямен қолдану мүмкіншілігі;
Жоғары тазалығының арқасында электротермиялық фосфор қышқылын жуғыш заттар, қоректендіргіш заттар және техникалық фосфаттар өндірісінде пайдаланады.
Үшкальцийфосфатты термиялық диссоциациялау арқылы тікелей фосфор (V) оксидін алу мәселесі қызығушылық тудыруда: Ca3(PO4)2= 3CaO+P2O5 +DH
Кальций карбонатын диссоциациялаудың өнеркәсіптік процесімен аналогия бойынша:
СаСО3= СаО+СО2+ DН мұндағы D Н = 178кДж
Дегенмен бұл процесті жүргізуге жоғары температура және көп мөлшерде энергия шығыны керек.
№9 ЛЕКЦИЯ. Байланысқан азот технологиясы, аммияк өндірісі, азот қышқылын өңдеу
Аммиак өндірісінің шикізаты. Аммиак өндірісіндегі шикізат стехнометриялық құрамы N2 :Н2 =1:3 азот сутегі қоспасы болып табылады. Аммиак өндірісіндегі шикізаттың екінші компонент-сутегін қайтымды кокстелген газдан, қатты жанармайдың газификациясы мен табиғи газдың конверциясы арқылы өндіріледі. Аммиак өндірісіндегі шикізат ресурстары 4.15 суретте көрсетілген.

Сурет 4.15. Шикізат ресурстары.
Аммиак өндірісінің шикізат базасының құрлымы өзгереді. Және қазіргі кезде аммиактың 90% табиғи газ негізінде өндіріліп отыр.
Азот сутектік қоспаның алыну әдісіне қарамастан құрамында бөтен қоспалар кездеседі. Олардың кейбіреулері каталитикалық у болып табылады, катализатордың улануына алып келеді.Осы улы заттарды жою мақсатында АСҚ келесі тазалауға түседі, тазалаудың әдісі мен тереңдігі оның табиғатына және құрамына байланысты. Табиғи газ конверциясымен алынып отырған АСҚ құрамы көміртегі оксидін (ІV), метан, аргон, оттегі іздерін және 0,4%-ке дейін көміртегі оксидін (ІІ) құрайды.
АСҚ-ны тазалауда өндірісте келесі тәсілдер қолданылады: сұйық сорбентпен абсорбциялау (сұйық әдіс) және қатты адсорбентпен тазалау (құрғақ әдіс). Бұл тазалау процесі өндірістің әр түрлі кезеңдерінде жүруі мүмкін:
● Бастапқы газ оны конверсияға беру алдында;
● Конверсия газын көміртегі оксидінен (IV) тазалау үшін;
● аммиакты синтездеу алдында азотты сутекті қоспа (АСҚ жұқа тазалау).
Көміртегі оксидінен (IV), күкірт сутегінен тазалау үшін АСҚ-ны мұнараларда сілтілік қосылыстармен жуады. Сілтілік реагенттермен және тұрақсыз термиялық тұздарды түзейтін этанол-аминнің сулы немесе ыстық ерітіндісімен, диэтаноламиннің активтелген қоспасымен, калий ерітіндісімен жуады, келесі реакция түзіледі:

АСҚ-ны көміртегі (II) оксидінен тазалау үшін оны мысацетатының - мысамиакты ерітіндісімен жуу жүргізіледі.
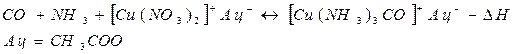
 Хемособрацияға қолданылатын абсорбенттер АСҚ-дан сіңіретін заттармен тұрақты емес қосылыстар түзейді. Сондықтан, олардың ерітіндісін қыздыру және қысымды төмендету кезінде еріген қоспалардың десорбциясы жүреді, бұл абсорбентті оңай қалпына келтіруге, оны процеске қайтадан жіберуге және үлгі бойынша абсорбция операциясының циклін қамтамасыз етуге мүмкіндік береді:
Хемособрацияға қолданылатын абсорбенттер АСҚ-дан сіңіретін заттармен тұрақты емес қосылыстар түзейді. Сондықтан, олардың ерітіндісін қыздыру және қысымды төмендету кезінде еріген қоспалардың десорбциясы жүреді, бұл абсорбентті оңай қалпына келтіруге, оны процеске қайтадан жіберуге және үлгі бойынша абсорбция операциясының циклін қамтамасыз етуге мүмкіндік береді:
мұндағы: П - АСҚ-дан сіңірген қоспа: А- абсорбент, ПА- қоспа мен абсорбент қосылысы.
Көміртегі оксидінен АСҚ тазалаудың ең тиімді әдісі көміртегі оксидімен (ІІ) қатар метан және аргон, процесс барысында жойылатын 190°С температурада қазіргі заманғы қондырғыда АСҚ сұйық азотпен жуу болып табылады.
АСҚ толық тазалау метандау немесе алдын- ала катализдеу деп аталатын қоспаларды каталиттік гидрлеу жолымен жүзеге асырылады. Бұл процесс арнайы метандау қондырғысында (4,16-сурет) 250-300°С температурада және шамамен 30 МПа қысымда никель-алюминий катализаторында (Ni+Al2O3) жүргізіледі. Бұл кезде темір катализаторға улы болып табылатын метанға дейін құрамында оттегі бар қоспаларды тотықтырудың экзотермиялық реакциялары жүреді, ал су тазаланған газды салқындату негізінде конденцацияланып одан бөлінеді.


Сурет 4.16. АСҚ метандау қондырғысының үлгісі.
1- компрессор, 2- жылытқыш, 3- метандау реакторы,
4- су жылытқышы, 5-конденсатор, 6- ылғал бөлгіш.
Егер алдын-ала катализдеуде темір катализатор пайдаланылса, онда гидрлеу процесінде аммиактың біраз мөлшері түзіледі, бұл жағдайда алдын-ала катализдеу өнімді деп аталады.
Метандау процесі қарапайым жеңіл басқарылады. Экзотермиялық гидрлеу реакциясының жүруі есебінен бөлінген жылу аммиак өндірісінің жалпы энерготехникалық үлгісінде пайдаланылады.
Синтездеуге түсетін, тазартылған АСҚ, аргонның 0,00025 жалпы үлесін, метанның 0,0075 жалпы үлесін және өте күшті каталитикалық у болып табылатын көміртегі оксидінің (ІІ) 0,00004 жалпы үлесін құрайды.
Аммиак синтезінің теориялық негіздері. Аммиак түссіз, күшті тұншықтырғыш иісі бар газ. Негізгі физика – химиялық көрсеткіштері:
Температура, 0С
Қайнау..........................................................................(минус) 33,35
Балқу.............................................................................(минус) 77,75
Аумалы күйдегі...........................................................(плюс) 132,4
Аумалы күйдегі қысым, атм..................................................111,5
Мольдік көлем (0С, 760 мм су бағанасы);л...........................2,084
Тығыздық (0С, 760 мм су бағанасы); г/л................................0,771
Сұйық аммиак
Булану жылуы.................................................кДж/кг ккал/кг
Минус 500С........................................................1415 337,97
00С........................................................1260 300,52
500С........................................................1056 252,26
Суда өте жақсы ериді: 20 0С 1:700; 0 0С 1:2000 көлем.
Суда ерігенде 33,47 кДж/ моль бөлініп шығады. Судағы ерітіндісін мүсатір спирті деп атайды. Судағы 25 % ерітіндінің тығыздығы 0,9. Төмен температурада NH3×H2O, NH3×2H2O криссталогидраттарын бөліп шығаруға болады.
Аммиак синтезі реакциясының тепе – теңдігі реакциясы:
 N2+3H2 2NH3 + 89,01кДж (21,26 ккал) (4.16)
N2+3H2 2NH3 + 89,01кДж (21,26 ккал) (4.16)
қайтарымды, жылу бөлінеді және газ көлемі азаяды. Сондықтан Ле–шателье принципіне сәйкес, қысым үлкейгенде реакция оңға қарай жылжиды, демек, газ арасындағы аммиактың шоғыры өседі.
Мысалы, 300 ат (29,4 МН/м2) қысымда аммиактың газдағы шоғыры ~26,0 % болса, ал 600 ат (58,86 МН/м2) газдағы аммиак ~42%. Реакция тепе – теңдік константасын (тұрақтылығын)
 (4.17)
(4.17)
есептеу үшін эксперименттік мәліметтер бойынша Ларсон және Дордж төмендегі теңдеуді ұсынған:
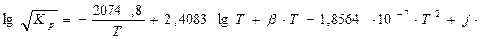 (4.18)
(4.18)
 -азот, сутек, аммиак газдарының парциалды қысымы β, j–газ қысымына байланысты коэффиценттер.
-азот, сутек, аммиак газдарының парциалды қысымы β, j–газ қысымына байланысты коэффиценттер.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 4039; Нарушение авторских прав?; Мы поможем в написании вашей работы!