
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры задач по теме 4
На детских каникулах программа с 11.00 действует по будням, кроме понедельника. На выходных (суб. - воскр.) проводим экскурсии с 15.00 до 17.00.
Стоимость экскурсии от 300 руб. - 1 ребенок в сопровождении взрослого.
Чтобы Вы узнали о них много интересного и познавательного!
Приглашаем Вас и Ваших детей в гости!
Дорогие друзья!
Вы окунетесь в чудесный и захватывающий мир прекрасных, добрых и благородных животных!
Показать полностью..
Познакомитесь с каждой лошадкой, узнаете сколько ей лет, что она любит кушать. Почему она живет в таком интересном домике и где любит гулять. Для чего ей нужны «ботинки» (копыта) на ногах. И какие она видит сны!
Расскажем какие разные лошадки живут на планете(про породы и масти)!!!
А еще Вы узнаете, что лошади умеют делать! Как они бегают и какие знают команды.
Для чего лошадкам одевают повод и как он работает.
У каждого будет возможность «порулить» лошадкой. Обязательно, перед чудесной конной каруселью, мы дружно расчешим лошадкам гривы и хвостики!
Вас встретит чудная мохнатая и безумно-добрая собака Куся!
А на втором этаже конюшни Вас ждут теплые мурлыкающие коты. И, конечно, мы!!!
Волшебные впечатления, радостные эмоции и зализанные руки – обеспечены!
Дорогие мальчишки и девчонки, а так же их родители!
Лошадки очень ждут вас к себе в гости, и очень хотят,
Программа:
11.00 – прибытие, встреча, знакомство с группой, рассказ о технике безопасности и о лошадках
11.15 – совместная чистка лошадей, выход в манеж
11.30 – катание с инструкторами, фотографирование
12.30 – перекус (по желанию) / катание с инструкторами
13.00 – выступление воспитанников КТГ Багмута «Казачья джигитовка» (в зависимости от грунта)
13.15 – прощание с лошадками
Программа может меняться походу и по обстановке.
С собой брать нарезанные морковку и яблочки – угощение для лошадок. Бутерброды для себя. Горячий чай обеспечим. Есть микроволновая печь.
Экскурсии проводим для детей трех категорий:
1 категория – от 4 до 6 лет (включительно)
2 категория – от 7 до 12 лет (включительно)
3 категория – от 13 до 16 лет (включительно)
Для подростков (3 категория) рассказ приобретает более энциклопедическую форму + обучение седловки лошади и основам верховой езды.
Группы 1 и 2 категорий набираем от 5 до 10 человек.
Группа 3 категории от 5 до 10 человек.
Если группа смешанная, то обсуждаем программу вместе и заранее.Если группа смешанная, то обсуждаем программу вместе и заранее.
Стоимость экскурсии:
1 ребенок в сопровождении взрослого 4-6 лет - 300 руб.
1 ребенок в сопровождении взрослого 7-12 лет - 400 руб.
1 ребенок в сопровождении взрослого 13-16 лет - 500 руб.
Задача 1. Cоставьте уравнения электродных процессов в цинк-серебрянном ГЭ, рассчитайте Е 0Э при 298 К (двумя способами) и Е Э при 298 К и aктивностях ионов Zn2+ и Ag+ в электролитах, равных 0,01 моль/л.
Решение. Из справочной таблицы: 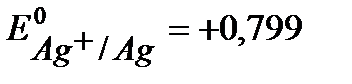 В,
В, 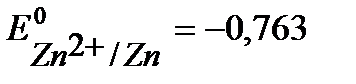 В. Т.к.
В. Т.к. 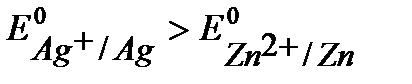 Þ Ag – катод, Zn – анод.
Þ Ag – катод, Zn – анод.
-А: Zn® Zn+2 + 2e 1
+K: Ag+ + e ® Ag 2 2
ТОР: Zn + 2Ag+ ↔ Zn+2 + 2Ag
1) 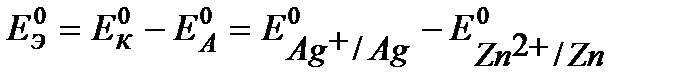 = 0,799 – (– 0,763) = 1,562 В 2)
= 0,799 – (– 0,763) = 1,562 В 2)
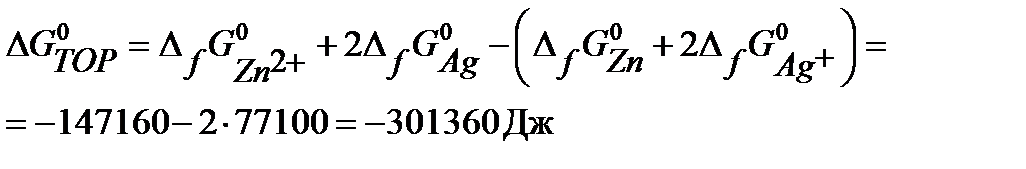
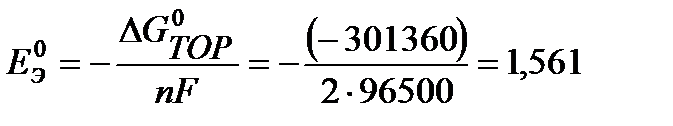 B.
B.
Для нахождения Е э(при а ≠1) по уравнению Нернста для металлических электродов определяем:
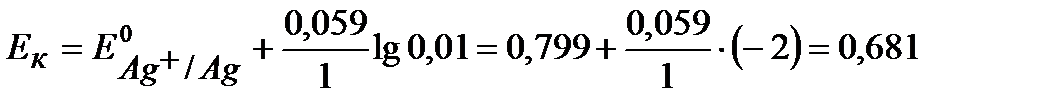 B.
B.
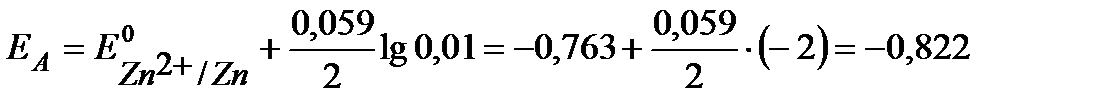 B.
B.
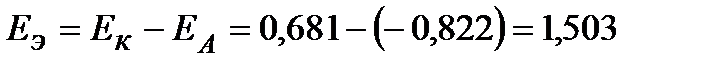 В. ЕЭ0 > ЕЭ
В. ЕЭ0 > ЕЭ
Задача 2. Рассчитайте ЭДС концентрационного ГЭ:
H2, P t | НCl || СН3СООН| H2, Pt, работающего при одинаковых давлениях 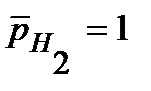 и одинаковых концентрациях водных растворов кислот c0 = 0,1 моль/л.
и одинаковых концентрациях водных растворов кислот c0 = 0,1 моль/л.
Решение. Для кислой среды уравнения электродных реакций в концентрационном элементе:
А -: H2 → 2H+ + 2 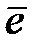
К+: 2H+ + 2 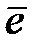 → H2
→ H2
Величина равновесного потенциала этих электродов определяется по уравнению Нернста:
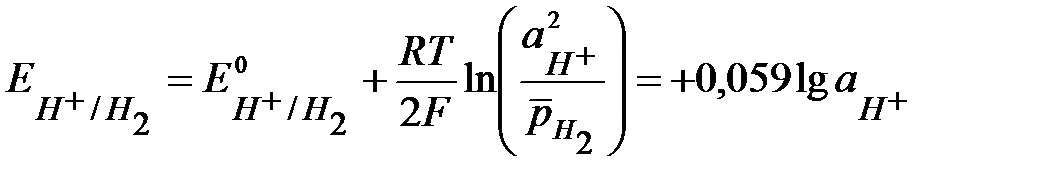 , при
, при  .
.
Рассчитаем активность ионов водорода  :
:
а) в растворе: СН3СООН  СН3СООН– + H+,
СН3СООН– + H+,
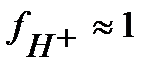 и
и 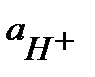 ≈
≈ 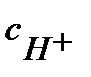 ; константа диссоциации Кд = 1,75 10-5
; константа диссоциации Кд = 1,75 10-5
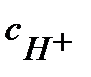 = α с 0, где степень диссоциации
= α с 0, где степень диссоциации 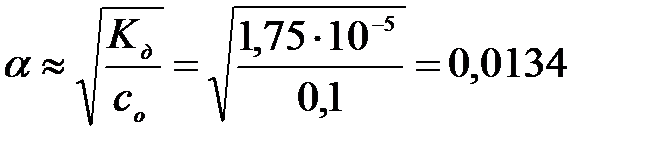 итогда
итогда 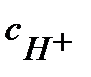
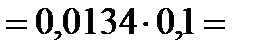
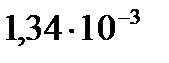 , следовательно
, следовательно 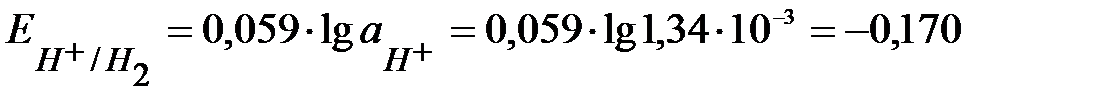 В.
В.
б) в растворе: HCl → H+ + Cl–,
рассчитываем ионную силу раствора:
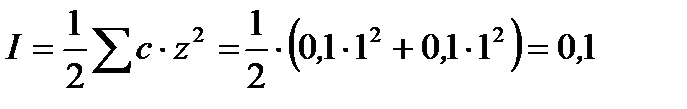 ,
,
по таблице находим коэффициент активности 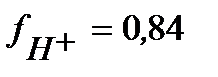 и тогда:
и тогда:
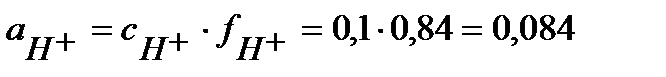 ,
, 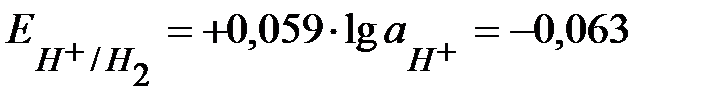 В.
В.
Т.к. 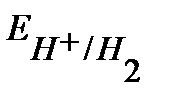 , рассчитанный для соляной кислоты больше, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом - электрод погруженный в раствор
, рассчитанный для соляной кислоты больше, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом - электрод погруженный в раствор
уксусной кислоты. 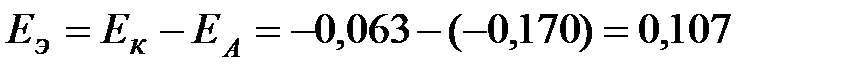 В.
В.
Задача 3. Составьте уравнения процесса электролиза водного раствора Na2SO4 на Ni-электродах. Рассчитайте объемы газов (н.у.), которые образуются на электродах за 0,2 часа при токе 5А и ВО2 = 60%. Покажите ход поляризационных кривых.
Решение. Ионный состав раствора:
Na2SO4 ж → 2Na+p + SO42-p
Н2Ож ↔ Н+р + ОН-р
гидролиза нет: рН = 7. Равновесные потенциалы возможных электродных процессов:
[- K]: Е0Na+/ Na = - 2,9 В ЕН+/Н2 = -0,059рН = -0,41 В
[+A]: SO42- -не окисляется, ЕО2/ОН- =1,23-0,059рН=0,82 В
Е0Ni2+/ Ni = - 0,025 В Þ ∆ E < 1 Þ два процесса
[- K]: 2Н+ + 2 е → Н2↑ ВН2= 100%
[+A]: Ni0 → Ni2+ + 2 e ВNi <100%
2ОН- → 1/2О2 ↑ + Н2О + 2 е BO2<100%
Уже в первые секунды Ni покрывается пассивной плёнкой и его растворение заканчивается.
По закону Фарадея:
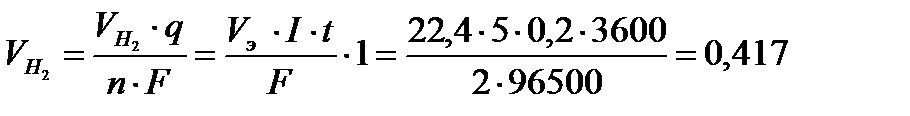 л
л 
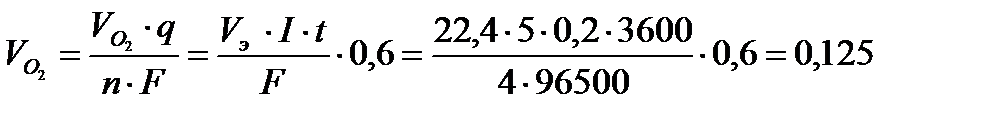 л
л
Задача 4. Определите объем Cl2, выделившийся при электролизе водного раствора NaCl на угольных электродах, если объем выделившегося при этом Н2 - 44,8 мл (н.у.). Выход по току хлора – 80%.
Решение. Ионный состав раствора:
Na Cl → Na+ + Сl-
H2O ↔ H+ + OH-
рН =7 ( гидролизa соли нет).
Потенциалы возможных процессов:
ЕрН+/Н2 = -0,059рН = -0,41 В
ЕрО2/ОН- =1,23-0,059рН = +0,81 В;
Е0Сl2/Cl- = + 1,36 В
Е0Сl2/Cl- - ЕрО2/ОН- < 1 Þ возможны оба процесса
Электродные процессы:
[- K]: 2Н+ + 2 е → Н2↑
[+A]: 2ОН- → 1/2О2 ↑ + Н2О + 2 е
2Cl- → Cl2 + 2 e
По закону Фарадея:
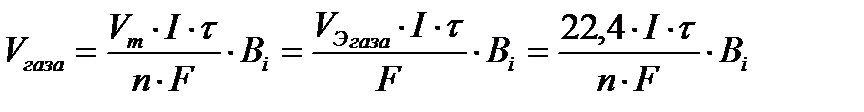
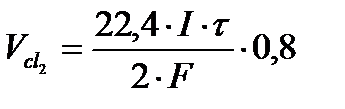 . Поскольку:
. Поскольку:
Q K = Q A = I ∙t и В Н2 = 1, то из
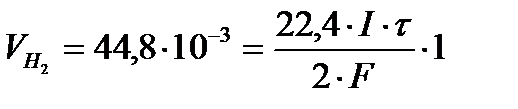 Þ
Þ 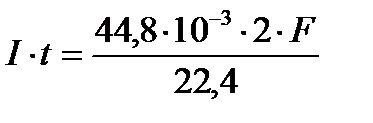
Þ 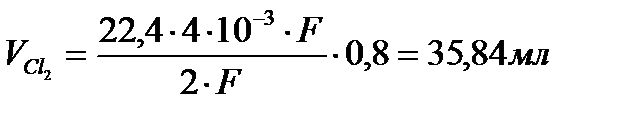
Задача 5. Рассмотрите процесс рафинирования Ni, содержащего примеси Zn и Cu в растворе H2SO4. Какие процессы будут протекать на катоде и аноде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
|
|
Дата добавления: 2014-12-10; Просмотров: 633; Нарушение авторских прав?; Мы поможем в написании вашей работы!