
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Ионный состав: H+, Ni2+, OH-, SO42-
|
|
|
|
Решение.
Ионный состав раствора:
H2SO4 → H+ + SO42-
H2O ↔ H+ + OH- рН=2
Запишем потенциалы возможных электродных процессов
ЕрО2/ОН- =1,23-0,059рН = +1,112 В;рН+/Н2 = -0,059рН = -0,118 В
Е0Ni2+/Ni = - 0,250 В
Е0Zn2+/Zn = -0,76 В;
Е0Сu2+/Cu = + 0,337 В
Т.к. Е0Zn2+/Zn < Е0Ni2+/Ni < Е0Cu2+/Cu < EpO2/OH- то первым на аноде окисляется Zn, затем очищаемый М – Ni, примеси Cu не растворяются, а выпадают в осадок (шлам). Т.к. Е0Ni2+/Ni > Е0Zn2+/Zn, то на катоде осаждается чистый никель.В начале процесса в растворе отсутствуют ионы Ni2+ и на катоде выделяется Н2.
Þ [+A]: Zn0 → Zn2+ + 2 е
Ni0 → Ni2+ + 2 е
[- K]: 2Н+ + 2 е → Н2↑
Ni2+ + 2 е → Ni0
Время для рафинирования по закону Фарадея (Мэ,Ni=29,5 г/моль):
 или τ = 9,27 ч
или τ = 9,27 ч
Задача 6. Рассчитайте толщину никелевого гальванопокрытия стального изделия, поверхностью 1 м2 при электролизе (с никелевым анодом) в течение 1 часа из водного раствора на основе NiSO4, плотности тока – 100 А/м2, выходе по току Ni на катоде – 0,8 (плотность Ni: ρ=8,9 г/см3, рН принять=7).
Сравнивая значения электродных потенциалов, записываем последовательность возможных электродных процессов:
[- K]: Ni2+ + 2 e → Ni
2Н+ + 2 е → Н2↑
[+A, Ni]: Ni → Ni2+ + 2 e
2ОН- →1/2 О2 ↑ + Н2О + 2 е
По закону Фарадея на катоде:

Т.к. V=m/ρ= S∙δ, то толщина Ni- покрытия на изделии равна:
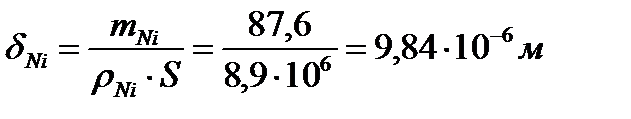 (9,84 мкм)
(9,84 мкм)
Задача 7. Определите термодинамическую возможность газовой коррозии низкоуглеродистой стали (Fe) под действием О2 (р О2 = 5 атм.) при 6000С, если известно, что коррозия стали (Fe) под действием О2 протекает следующим образом:
До 4000С:2Fe + 3/2O2→Fe2O3- пассивная плёнка,
при 400 – 5750С образуется смесь Fe2O3 и FeO,
а свыше 5750С: Fe + ½ O2→ FeO – защитные свойства отсутствуют.
При расчете зависимостью ∆rН и ∆rS от температуры можно пренебречь.
Решение. Для определения термодинамической возможности газовой коррозии Fe под действием O2 определим изменение энергии Гиббса в этих условиях, предварительно составив уравнение реакции: Fe + ½ O2 (г)→ FeO. Согласно справочным данным:
∆rG0=∆H0 - T∆S0 = -263800 - 873∙(-70,36) = -202376Дж
Затем применяем уравнение изотермы Вант Гоффа:
D rG = D rG 0 + RT ln(1/ p 1/2O2)= D rG 0 –1/2 RT ln p O2 =
-202376 -½8,3∙873∙ln5= -207651,5Дж < 0,
т.е. газовая коррозия термодинамически возможна.
Задача 8. Определите давление О2, при котором прекращается газовая коррозия низкоуглеродистой стали при 6000С.
Решение. Fе + 1 / 2 О2 (г) =FеО. Коррозия прекращается при D rG= 0
D rG = D rG 0 + RT ln(1/ p 1/2O2)= D rG 0 -1/2 RT ln р О2 = 0
lg p О2 = -201822•2/2,3 R T = -24 р О2 =10-24
Задача 9. Определите примерную температуру, при которой газовая коррозия Fe по реакции Fе + 1 / 2 О2 (г) =FеО в стандартных условиях прекращается.
Решение. Прекращается при D rG= 0. Рассчитаем приблизительную Т.
∆rG0 = ∆r H0 - T∆r S0 =0 Исходя из справочных данных:
T = ∆r H0 / ∆r S0 = (-263800)/(- 70,36) = 3749 К
Из задачи 8 и9: D G > 0, т.е. газовая коррозия прекращается при очень низких давлениях кислорода и высоких температурах.
Задача 10. Сравните коррозионные процессы, протекающие на двух Fe-изделиях: 1 - с покрытием из Sn и 2 –с покрытием из Zn в электропроводящей среде при рН=3 и доступе воздуха и сделайте вывод о надежности этих покрытий.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 667; Нарушение авторских прав?; Мы поможем в написании вашей работы!