
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Как видно, процессы при нарушении анодного покрытия не меняются
|
|
|
|
Оцинкованное железо Zn/Fe
а)Сравниваем стандартные потенциалы основного металла и покрытия:
Е0 Zn2+/Zn = - 0,763 B
E0 Fe2+/Fe = - 0,440 B Þ покрытие анодное.
б) Определяем равновесные потенциалы окислителей в
заданной среде (рН=3)
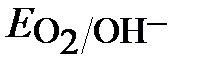 ≈ 1,23 – 0,059рН ≈ 1,05В
≈ 1,23 – 0,059рН ≈ 1,05В
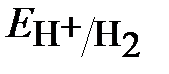 ≈ – 0,059рН ≈ -0,18В
≈ – 0,059рН ≈ -0,18В
в) Сравниваем значения потенциалов окислителей и
металла-анода, делаем вывод о возможности данного
процесса коррозии
2 случая:
1. Покрытие не нарушено.
- 0,763 < 1,05 Þвозможна коррозия с поглощением кислорода
- 0,763 < -0,18 Þ возможна коррозия с выделением водорода
(A) Zn → Zn2+ + 2e
(К) O2 + 4H+ + 4 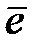 → 2Н2О
→ 2Н2О
2H+ + 2 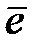 → H2
→ H2
2. Покрытие нарушено.
- 0,763 < 1,05 Þвозможна коррозия с поглощением кислорода
- 0,763 < -0,18 Þвозможна коррозия с выделением водорода
(A) Zn → Zn2+ + 2e
(К) 2H+ + 2 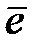 → H2
→ H2
O2 + 4H+ + 4 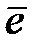 → 2H2O
→ 2H2O
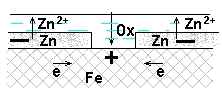
При повреждении анодного покрытия возникает коррозионный ГЭ, в котором основной материал -катод → не растворяется, на нем выделяется водород или поглощается кислород, а материал покрытия – анод →разрушается.
Задача 11. Для Аg/Br2 гальванического элемента:
-составьте уравнения анодной, катодной и токообразующей реакций;
- рассчитайте максимальную теоретическую величину энергии элемента (Вт∙ч) при уменьшении массы анода в результате анодной реакции на 1 грамм (при стандартных состояниях веществ и 298 К).
- объясните, почему напряжение элемента меньше рассчитанной Вами стандартной ЭДС, покажите ход поляризационных кривых и предложите условия, позволяющие увеличить напряжение;
Решение. Так как Е 0Ag < Е 0Br2, анод –серебряный электрод. Уравнения процессов, протекающих на аноде и катоде в работающем Аg/Br2 ГЭ и уравнение токообразующей реакции:
А: 2Аg → 2Аg+ + 2е - окисление
К: Br2 + 2е → 2Br - - восстановление
ТОР: 2Аg + Br2 ↔ 2Аg+ + 2Br -
Рассчитываем Е 0Э ГЭ при с.с. и 298 К:
Е 0Э = Е 0К - Е 0А = Е 0 Br2 /Br - - Е 0 Аg+/Аg = 1,065 - 0,799 = 0,266 В.
Максимальная теоретическая энергию ГЭ, которую он может отдать при разряде и потере массы анода в 1 грамм равна: W = QE 0Э (где Q -
максимальное количество электричества, которое может отдать элементА∙ч). Q находим из следствия 2 закона Фарадея:
Q = (m /MЭ)∙(F /1) = (1 г ∙26,8 А∙ч /108 г/м э ∙1м э) = 0, 248 А∙ч
W = 0, 248 А∙ч ∙ 0,266 В= 0,066 Вт∙ч.
Равновесные потенциалы электродов и ЭДС могут быть определены в условиях отсутствия тока в цепи. В работающем ГЭ при прохождении электрического тока уменьшается концентрация исходных реагентов и увеличивается концентрация продуктов реакции: потенциал анода становится менее отрицательным, потенциал катода – менее положительным(поляризация электродов). Помимо этого возникают омические потери. В результате напряжение гальванического элемента меньше ЭДС:
U = Е Э - I . R - D Е А -D Е К ,
Изменение потенциалов электродов под действием тока отражают поляризационные кривые: 
Для увеличения напряжения гальванического элемента Аg/Br2 можно:
- Снизить поляризацию электродов. Для этого обеспечить постоянный подвод реагентов (Br2), отвод продуктов реакции (Br- и Аg+); обеспечить перемешивание раствора; применить катализатор; повысить температуру; повысить площадь поверхности электродов (пористые, гофрированные электроды).
- Уменьшить сопротивление системы путем сближения анода и катода, применением проводников с низким сопротивлением.
Задача12. Для водного раствора Fe(NO3)2:
1) составьте уравнения электродных процессов, протекающих на Pt -электродахпри электролизе ;
2) рассчитайте напряжение разложения при 298К; объясните, почему напряжение, подаваемое на электролизёр больше напряжения разложения, предложите условия, которые позволят уменьшить подаваемое напряжение;
3) рассчитайте массу (г) металла, восстановленного на катоде (S=1м2) при пропускании через электролизёр тока, силой 12A в течение 3 часов и выходе металла по току, равном70%
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 610; Нарушение авторских прав?; Мы поможем в написании вашей работы!