
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды pH
|
|
|
|
Определим ионный состав раствора электролита и оценим водородный показатель среды pH. Уравнения диссоциации молекул соли и воды:
Fe(NO3)2 → Fe2+ + NO3-
H2O ↔ H+ + OH- .
Соль Fe(NO3)2 образована слабым основанием Fe(OН)2 и сильной кислотой НNO3, следовательно, при ее растворении в воде протекает процесс гидролиза:
Fe2+ + H2O ↔ FeОН+ + H+
FeОН+ + H2O ↔ Fe(ОН)2 + H+
с образованием избытка ионов Н+, и раствор электролита имеет слабокислую реакцию среды. Примем рН=5.
Определим равновесные потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
Е 0Fe2+/Fe = -0,440 B -справочные данные[1],
Е р Н+/Н2 = - 0,059 . pH = -0,295 B (по уравнению Нернста при 298 К), т.к. значения потенциалов Е 0Fe2+/Fe и Е рН+/Н2 близки, то на катоде будут протекать процессы восстановления ионов железа Fe2+ и ионов Н+ из раствора электролита.
Pt - нерастворимый анод, по уравнению Нернста при 298 К:
E рО2 / ОН- = 1,23 - 0,059 .pH = + 0,935 В
ионы NO3-, как сложные кислородсодержащие ионы, на аноде окисляться не будут, и в данном растворе электролита на аноде будет идти один процесс окисления ионов ОН-.
Уравнения электродных процессов при электролизе на Pt –электродах:
K-: 2Н+ + 2e → Н2
Fe2+ + 2e → Fe
A+: 4OH- → 2O2 + 4H+ + 4e
В ходе процесса электролиза на катоде расходуются ионы Н+ - среда становится менее кислой; на аноде образуются ионы Н+ - среда дополнительно подкисляется. При прохождении тока при электролизе изменяются потенциалы электродов электролизера, т.е. возникает электродная поляризация. В результате катодной поляризации потенциал катода становится более отрицательным; в результате анодной поляризации потенциал анода становится более положительным. Кроме того, имеются омические потери в проводниках 1-го и 2-го рода. В результате напряжение электролизера больше минимальной разности потенциалов (напряжения разложения):
U = U р + I . R + D Е А +D Е К ,
Теоретическая минимальная разность потенциалов U р, которую необходимо подать на Pt –электроды для начала проведения электролиза раствора электролита Fe(NO3)2 равна разнице равновесных потенциалов первых процессов, протекающих на аноде и катоде:
U р = Е А - Е К = E О2 / ОН- - Е Н+/Н2 = 0,935- (-0,295) = 1,23 В,
Количество веществ (железо и водород), выделившихся на катоде, рассчитаем по закону Фарадея:
для массы вещества: m = 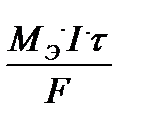 Bi;
Bi;
для объема газа: V = 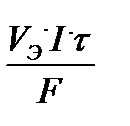 Bi,
Bi,
где М Э - молярная масса эквивалента вещества, г/моль;
V Э - объем моля эквивалента газа, л/моль;
I - сила тока, А;
τ - время процесса, с;
F = 96500 Кл/моль-экв. - постоянная Фарадея.
Bi – выход по току вещества
Электролиз проводился при силе тока I =12 Ав течение времени t =3 час=10800c; выход металла по току BFe =70%
Запишем объем моля эквивалента водорода при нормальных условиях (Т =273 К, р = 105 Па) и массу моля эквивалента железа:
V 0э, H2 = 11,2 л/моль, M э, Fe = 27,9 г/моль.
тогда m Fe = 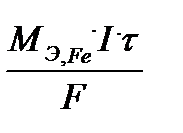 . Bi Fe =
. Bi Fe = 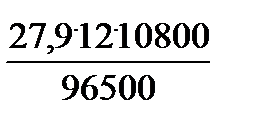 . 0,7 = 26,25 г;
. 0,7 = 26,25 г;
V H2 = 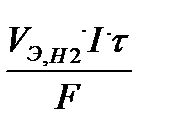 . Bi Н2 =
. Bi Н2 = 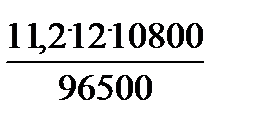 .0,3 = 4,5 л.
.0,3 = 4,5 л.
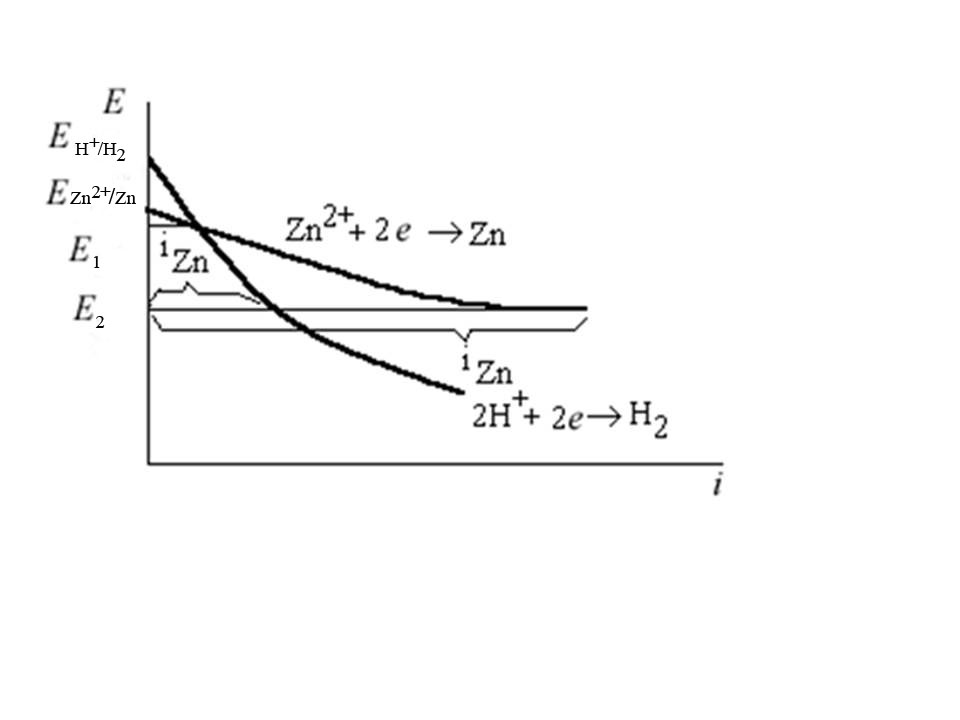
Задача 13. Для водного раствора ZnCl2:
1)составьте уравнения электродных процессов при гальванопокрытии Fe-изделия цинком с использованием графитового анода ;
2)покажите ход поляризационных кривых,
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды pH.
ZnCl2 → Zn2+ + 2Cl-
H2O ↔ H+ + OH- pH ~ 6
K -: 2Н+ + 2e → Н2
Zn2+ + 2e → Zn
A+: 4OH- → 2O2 + 4H+ + 4 e
2Cl- → Cl2 + 2 e

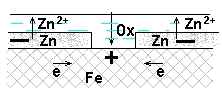
Задача 14. Для изделия из сплава Zn - Fe :
1) определите термодинамическую возможность его электрохимической коррозии в среде с рН=3 при 298К и контакте с воздухом (р Н2=1, р О2 =0,21); составьте уравнения процесса коррозии;
2) рассчитайте силу коррозионного тока, если за 2 час. протекания коррозии на поверхности образовалось 8∙10-2 молей эквивалента продуктов коррозии;
Решение. а)Сравниваем стандартные потенциалы металлов:
Е0 Zn2+/Zn = - 0,763 B Þанодные участки
E0 Fe2+/Fe = - 0,440 B Þ катодные участки
б) Определяем равновесные потенциалы окислителей в
заданной среде (рН=3, р О2 = 0,21)
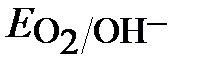 ≈ 1,217 – 0,059рН ≈ 1,04В
≈ 1,217 – 0,059рН ≈ 1,04В
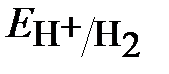 ≈ – 0,059рН ≈ -0,18В
≈ – 0,059рН ≈ -0,18В
в) Сравниваем значения потенциалов окислителей и
металла-анода, делаем вывод о возможности данного
процесса коррозии
- 0,763 < 1,04 Þвозможна коррозия с поглощением кислорода
- 0,763 < -0,18 Þ возможна коррозия с выделением водорода
(A) Zn → Zn2+ + 2e
(К) O2 + 4H+ + 4 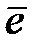 → 2Н2О
→ 2Н2О
2H+ + 2 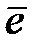 → H2
→ H2
Cила коррозионного тока I = Q/t. Согласно следствия из 2 го закона Фарадея количество прошедшего через систему электричества Q равно: Q = F (Кл) ∙ n (м э) /1(м э) =
= 96500 ∙ 8 ∙ 10-2 = 7720 Kл, а сила коррозионного тока
I = 7720Кл /2∙3600с = 1,072 A.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 2305; Нарушение авторских прав?; Мы поможем в написании вашей работы!