
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквивалент. Закон эквивалентов
|
|
|
|
Эквивалент (Э) – это реальная ли условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При определении эквивалента вещества необходимо исходить из конкретной реакции.
Например: Из уравнения реакции 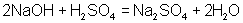 .
.
Следует, что одному иону водорода соответствует одна молекула 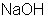 и одна
и одна 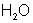 ,
, 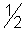 молекулы
молекулы 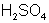 и
и 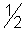 молекулы
молекулы 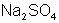 , поэтому Э(
, поэтому Э( 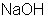 )=
)= 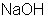 , Э(
, Э( 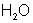 )=
)= 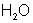 (это реальные частицы); Э(
(это реальные частицы); Э( 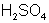 )=
)= 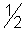
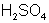 , Э(
, Э( 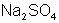 )=
)= 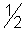
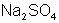 (это условные частицы).
(это условные частицы).
Моль эквивалентов – количество вещества, содержащего 6,022×1023 эквивалентов. Масса одного моля эквивалентов вещества (элемента) называют молярной массой эквивалентов вещества 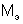 , г/моль.
, г/моль.
Например:
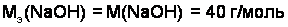 ;
;
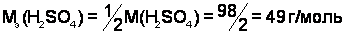 ;
;
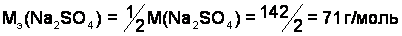 .
.
Число, обозначающее какая доля от реальной частицы эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях, называют фактором эквивалентности fэ.
Например: Врассмотренных примерах: fэ( 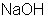 ) = 1; fэ(
) = 1; fэ( 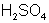 ) =
) = 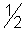 ; fэ(
; fэ( 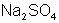 ) =
) = 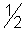 .
.
Закон эквивалентов (И.В. Рихтер, 1809)
Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
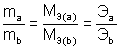 , (4)
, (4)
где 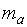 и
и 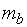 – массы веществ, г;
– массы веществ, г; 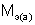 и
и 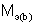 – молярные массы эквивалентов веществ, г/моль;
– молярные массы эквивалентов веществ, г/моль; 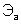 и
и 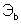 – эквиваленты веществ, моль.
– эквиваленты веществ, моль.
Если одно из веществ или оба вещества, вступивших или получившихся в результате реакции, находится в газообразном состоянии, закон эквивалентов принимает вид:
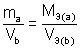 или
или 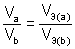 , (5)
, (5)
где 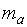 – масса твердого или жидкого вещества, г;
– масса твердого или жидкого вещества, г; 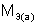 – молярная масса эквивалента твердого (жидкого) вещества, г/моль;
– молярная масса эквивалента твердого (жидкого) вещества, г/моль; 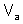 ,
, 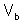 – объем газообразного вещества (н.у.), л;
– объем газообразного вещества (н.у.), л; 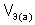 ,
, 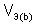 – молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
– молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
4. Закон объёмных отношений газов.
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку, автору известного закона о тепловом расширении газов. Измеряя объемы газов, вступающих в реакцию и образующихся в результате реакции, Гей-Люссак пришел к обобщению, известному под названием закона простых объемных отношений или «химического» закона Гей-Люссака:
Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуются 2 объема водяного пара.
Конечно, при этом предполагается, что все измерения объемов проведены при одном и том же давлении и при одной и той же температуре.
5. Закон Авогадро
В 1811 г. итальянский физик Авогадро объяснил простые отношения между объемами газов, наблюдающиеся при химических реакциях, установив закон:
В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул.
Этот закон (закон Авогадро) вводил в науку представление о молекулах как о мельчайших частицах вещества. При этом представление об атомах как о мельчайших частицах элемента сохранялось. Авогадро особенно подчеркивал, что молекулы простых веществ отнюдь не должны быть тождественны с атомами: напротив, они обычно состоят из нескольких атомов данного элемента,
Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов. В частности, на его основе было предположено, что молекулы таких газов, как водород, хлор, кислород, азот, состоят из двух атомов. Это предположение объяснило установленные Гей-Люссаком отношения между объемами газов.
Закон Авогадро сыграл большую роль в установлении атомных масс элементов и молекулярных масс сложных веществ (см. § 10).
6. Что показывает порядковый номер хим. Элемента.
Порядковый номер элемента показывает:
- заряд ядра атома
- число протонов и электронов
2) Номер периода говорит нам о количестве энергетических уровней
3) Номер группы дает нам информацию о числе электронов на внешнем уровне
K - калий, №19, 4 период, 1 группа, гл. подгруппа.
+19)))) число элетронов = числу протонов = № элемента = 19, 4 период = 4
2 8 8 1 уровня,1 группа = 1 элетрон на внешнем уровне
Cl - хлор, №17, 3 период, 7 группа, гл. погруппа
+17))) число электронов = числу протонов = № эл - та = 17, 3 пер. = 3 уровня,
2 8 7 7 группа - 7 внешних электронов
Mn - марганец(тут по - хлеще дело будет) №25, 4 период, 7 группа, побочная подгруппа, вот из-за того, что марганец находится в побочной подгруппе распределение электронов будет несколько иным, по сравнению с предыдущими примерами, смотрим:
+25)))) ne(число эл-в) = np(число пр - в) = № эл. = 25, 4 пер. = 4 уровня
2 8 13 2 7 группа =...БАХ! 2 электрона (вот о чем я говорил когда только начал характеризовать атом марганца)
7. Формулировка периодического закона по Менделееву
Формулировка периодического закона, данная Д.И. Менделеевым, гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов.
8. Формулировка периодического закона на основе строение атома.
Современная формулировка гласит: свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов. Такое уточнение потребовалось, поскольку к моменту установления Менделеевым периодического закона еще не было известно о строении атома. После выяснения строения атома и установления закономерностей размещения электронов по электронным уровням стало ясно, что периодическая повторяемость свойств элементов связана с повторяемостью строения электронных оболочек.
9. Научные доказательства сложного строение атома.
Открытие электрона. Первые экспериментальные результаты, из которых можно было сделать вывод о сложной структуре атомов, о наличии внутри атомов электрических зарядов, были получены М. Фарадеем в 1883 г. при изучении законов электролиза.
В 1897 г. Дж. Дж. Томсон в результате экспериментов по изучению электрического разряда в разреженных газах, фотоэффекта и термоэлектронной эмиссии установил, что при соударениях атомов в плазме электрического разряда, при нагревании вещества или освещении его ультрафиолетовым светом из атомов любого химического элемента вырываются одинаковые отрицательно заряженные частицы. Эти частицы были названы электронами. Электрический заряд е отдельных электронов впервые был измерен в опытах Р. Милликена в 1909 г. Он оказался действительно одинаковым у всех электронов.
Масса электрона примерно в 2000 раз меньше массы самого легкого из атомов - атома водорода. Открытие электрона и обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложности атомов.
10.Общий план строение атома.
Строение атома было открыто в 1911 г. в результате экспериментов, которыми руководил английский ученый Э. Резерфорд. Идея опытов состояла в том, чтобы выяснить, что происходит с быстро-летящими частицами, когда на их пути оказываются атомы вещества.
Нужно сказать, что за несколько лет до этого было открыто явление радиоактивности: были обнаружены невидимые лучи, которые испускались некоторыми (теперь их называют радиоактивными) веществами (ураном, радием и др.). Изучение этих лучей показало, что в общем случае они состоят из трех компонентов, отличающихся друг от друга электрическим зарядом. Для обозначения отдельных видов радиоактивных излучений было предложено использовать первые три буквы греческого алфавита: α (альфа), β (бета) и γ (гамма).
Альфа-лучи состоят из положительно заряженных частиц (альфа-частиц), бета-лучи - из отрицательно заряженных частиц (электронов), гамма-лучи - никаким зарядом не обладают. Эти лучи опасны для человека. Поэтому, работая с радиоактивными препаратами, следует соблюдать особые меры предосторожности: использовать специальные защитные экраны и, конечно, никогда не брать эти препараты руками.
Резерфорд предложил использовать альфа-частицы в качестве тех «снарядов», которыми можно было бы «бомбардировать» атомы вещества. Направив узкий пучок этих частиц на тонкую пластинку (фольгу) исследуемого вещества, он обнаружил, что большинство альфа-частиц пролетало через фольгу почти беспрепятственно и лишь очень небольшая их часть, столкнувшись с чем-то внутри атома, отскакивала от фольги назад. Более подробно об опытах Резерфорда будет рассказано в старших классах. Здесь же мы ограничимся тем выводом, к которому он пришел на основе анализа полученных данных.
Согласно Резерфорду, атом по своему строению напоминает Солнечную систему. Подобно тому как планеты, притягиваясь к Солнцу, движутся вокруг него, так и электроны в атоме движутся вокруг ядра, удерживаемые силами притяжения к нему. Из-за этого сходства модель строения атома (рис.11), предложенную Резерфордом, назвали планетарной моделью.

Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!
Подсчитано, что если бы все электроны примкнули вплотную к атомным ядрам, то объем тела взрослого человека стал бы равным одной миллионной доле кубического миллиметра! Это означает, что более 99% внутри тела человека (как и любого другого тела) занимает пустота! Именно через пустоту внутри атомов и пролетали те альфа-частицы в опыте Резерфорда, которые не отклонялись фольгой назад.
11. Определение электролитов примеры
Можно сказать, что электролиты - это вещества, в которых в заметной концентрации присутствуют ионы, обусловливающие прохождение электрического тока (ионную проводимость). Электролиты также имеют название проводников второго рода.
В узком смысле слова электролиты - вещества, молекулы которых в растворе, вследствие электролитической диссоциации, распадаются на ионы. Среди электролитов различают твердые, растворы электролитов и ионные расплавы. Растворы электролитов часто также называют электролиты. В зависимости от вида растворителя электролиты делятся на водные и электролиты неводные. К особому классу относятся высокомолекулярные электролиты - полиэлектролиты.
В соответствии с природой ионов, образующихся при электролитической диссоциации водных растворов, выделяют солевые электролиты (в них отсутствуют ионы Н + и ОН -), кислоты (преобладают ионы Н +) и основания (преобладают ионы ОН -). Если при диссоциации молекул электролитов число катионов совпадает с числом анионов, то такие электролиты называют симметричными (1,1 - валентными, например, КСl, 2,2-валентными, например, CaSO 4, и т.д.). В противном случае электролиты называют несимметричными (1,2-валентные электролиты, напр. H 2 SO 4, 3,1-валентные, например, А1 (ОН) 3, и т.д.). В зависимости от способности к электролитической диссоциации электролиты условно разделяют на сильные и слабые. Слабые электролиты характеризуются, прежде всего, константой и степенью диссоциации, а сильные активностью ионов.
Молекулы слабых электролитов лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциирующими молекулами. К слабым электролитам относятся многие органические кислоты и основания в водных и неводных растворителях. Степень диссоциации зависит от природы растворителя, концентрации раствора, температуры и других факторов (<1)
Сильными электролитами называются такие электролиты, степень диссоциации которых в растворах равна единице (т.е. диссоциируют полностью) и не зависит от концентрации раствора. К ним относятся большинство солей, которые уже в кристаллическом состоянии построены из ионов, гидроксиды щелочных и щелочноземельных металлов, некоторые кислоты (НСl, HBr, HI, HClO 4, HNO 3).
12.Диссоциация кислот, солей, оснований.
с помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 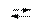 Н+ + Н2РО-4(первая ступень)
Н+ + Н2РО-4(первая ступень)
Н2РО-4 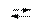 Н+ + НРO2-4 (вторая ступень)
Н+ + НРO2-4 (вторая ступень)
НРО2-4 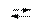 Н+ PОЗ-4 (третья ступень)
Н+ PОЗ-4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например:
KOH 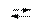 K+ + OH-; NH4OH
K+ + OH-; NH4OH 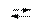 NH+4 + OH-
NH+4 + OH-
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН4ОН - однокислотное основание, Са(ОН)2 - двухкислотное, Fе(ОН)3 - трехкислотное и т.д. Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН)2 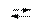 Са(ОН)+ + OH- (первая ступень)
Са(ОН)+ + OH- (первая ступень)
Ca(OH)+ 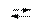 Ca2++OH- (вторая ступень)
Ca2++OH- (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Н2O 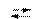 Н+ + ОН-
Н+ + ОН-
13. Степень диссоциации и факторы влияющие на неё.

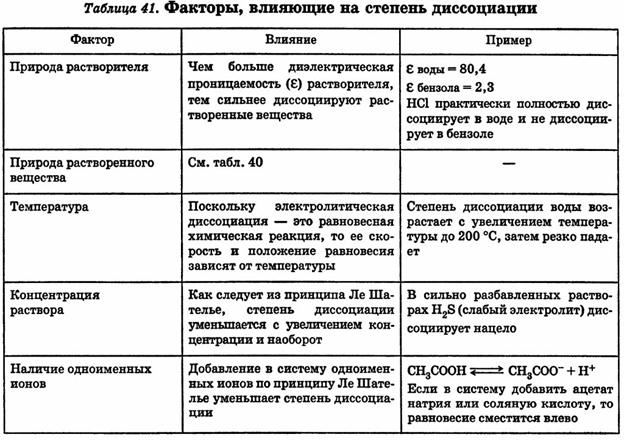
14. Слабые, средние и сильные электролиты.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
| Классификация электролитов | Сильные электролиты | Средние электролиты | Слабые электролиты |
| Значение степени диссоциации (α) | α>30% | 3%≤α≤30% | α<3% |
| Примеры | 1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.)); 3. Сильные основания – щёлочи. | H3PO4 H2SO3 | 1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2. Некоторые неорганические кислоты (H2CO3, H2S и др.); 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4. Вода. |
15.Реакции ионного обмена между кислотами и основаниями, солями и кислотами, между двумя солями.
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 2012; Нарушение авторских прав?; Мы поможем в написании вашей работы!