
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок составления ионных уравнений реакции
|
|
|
|
Правила составления ионных уравнений реакций
1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют.
2. В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
1. Записывают молекулярное уравнение реакции
MgCl2 + 2AgNO3 ® 2AgCl + Mg(NO3)2
2. Определяют растворимость каждого из веществ с помощью таблицы растворимости
| p | p | H | p | |||
| MgCl2 | + | 2AgNO3 | ® | 2AgCl | + | Mg(NO3)2 |
3. Записывают уравнения диссоциации растворимых в воде исходных веществ и продуктов реакции:
MgCl2 «Mg2+ + 2Cl-
AgNO3 «Ag+ + NO3-
Mg(NO3)2 «Mg2+ + 2NO3-
4. Записывают полное ионное уравнение реакции
Mg2+ + 2Cl- + 2Ag+ + 2NO3- ® 2AgCl¯ + Mg2+ + 2NO3-
5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Mg2+ + 2Cl- + 2Ag+ + 2NO3- ® 2AgCl¯ + Mg2+ + 2NO3-
Ag+ + Cl- ® AgCl
16. О.В.Р., определение, примеры.
Окислительно-восстановительные реакции в растворах.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд:
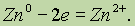
Если отрицательно заряженный ион (заряд -1), например Сl-, отдает 1 электрон, то он становится нейтральным атомом:
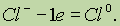
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:

Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
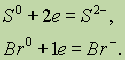
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
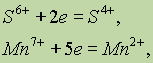
или он может перейти в нейтральный атом:
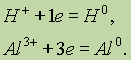
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, восстановитель — окисляется.
18-19. Важнейшие окислители и восстановители
Какие вещества могут проявлять свойства окислителей, а какие — восстановителей? Как уже говорилось, окислитель содержит в своем составе элемент, понижающий степень своей окисленности, а восстановитель содержит элемент, степень окисленности которого повышается в ходе реакции. Следовательно, окислителями могут быть прежде всего соединения высших, а восстановителями — низших степеней окисленности, присущих данному элементу.
Металлы проявляют в своих соединениях только положительную окисленность, и низшая их степень окисленности равна нулю. Иначе говоря, низшей степенью окисленности они обладают только в свободном состоянии. Действительно, все свободные металлы способны, хотя и в различной степени, проявлять только восстановительные свойства. На практике в качестве восстановителей применяют алюминий, магний, натрий, калий, цинк и некоторые другие металлы. Если металлу присущи несколько степеней окисленности, то те его соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например, соединения железа  , олова (II), хрома (II), меди
, олова (II), хрома (II), меди  .
.
Окислителями могут быть те соединения металлов, в которых степень окисленности металла велика — равна номеру группы, в которой находится металл, или близка к нему. На практике применяют, в частности: аммиачный раствор оксида серебра, аммиачный раствор сульфата меди (II), хлорид  , диоксид свинца
, диоксид свинца  , хлорид
, хлорид  , хромат и дихромат калия
, хромат и дихромат калия  и
и  , перманганат калия
, перманганат калия  , диоксид марганца
, диоксид марганца  .
.
Неметаллы проявляют как положительную, так и отрицательную окисленность. Естественно, что соединения, содержащие неметаллы в высших положительных степенях окисленности, могут быть окислителями, а соединения, в которых неметалл проявляет отрицательную окисленность, - восстановителями.
К широко применяемым в промышленности восстановителям относятся водород, углерод (в виде угля или кокса) и монооксид углерода СО.
К сильным окислителям принадлежат неметаллы верхней части VI и VII групп периодической системы. Сильные окислительные свойства этих веществ объясняются большой электроотрицательностью их атомов. Сильнее всего окислительные свойства выражены у фтора, но в практике чаще пользуются в качестве окислителей кислородом, хлором и бромом.
К соединениям, применяемым в качестве окислителей, относятся также кислоты. Наибольшее практическое значение имеют соляная, серная и азотная кислоты.
21.Схема и принцип действия гальванического элемента.
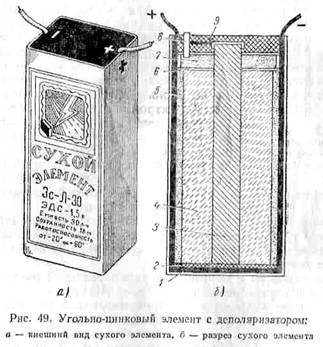
Гальванические элементы являются источниками постоянного напряжения и называются первичными элементами. Электрическая энергия, получаемая в этом случае, образуется в результате химических реакций, происходящих внутри элемента. Рассмотрим принцип действия простейшего гальванического элемента.
Элемент (рис. 48) состоит из сосуда с раствором серной кислоты (H2SО4), в которую погружены две разнородные пластины: цинковая и медная. Как показал опыт, цинк в этом случае заряжается

отрицательно, а медь — положительно. Элемент имеет два вывода — полюса: положительный (анод) и отрицательный (катод).
Цинковая пластина, опущенная в раствор серной кислоты, будет растворяться в ней. Способность цинка легко отдавать свой электроны приводит к тому, что атом цинка,.оставляя два своих электрона пластине,.Переходит в раствор в виде положительного иона. Между цинковой пластиной и раствором возникает некоторая разность потенциалов, которая приостанавливает дальнейшее растворение цинковой пластины.
Опустим в раствор медную пластину. Обладая меньшей способностью растворения, медь по отношению к раствору будет иметь иную разность потенциалов, чем цинк. Таким образом, между медной и цинковой пластинами образуется разность потенциалов.
Разность потенциалов (э. д. с.) между пластинами (электродами) медно-цинкового элемента равна 1,1 в.
При замыкании полюсов элемента металлическим проводником электроны цинковой пластины будут переходить на медную пластину. Вследствие потери электронов потенциал между цинковой пластиной и раствором уменьшается и новая порция ионов цинка перейдет с пластины в раствор, причем сама пластина вновь обогащается электронами. Положительные ионы цинка, попав в раствор, соединяются с отрицательными ионами кислотного остатка SO4-- и образуют молекулу цинкового купороса
ZnS04.
Положительный ион водорода H2++. подходя к медной пластине,
берет у нее свободные электроны и, нейтрализуясь, выделяется в виде пузырьков, покрывающих медную пластину. В результате указанного процесса цинковая пластина, растворяясь в кислоте, пополняется электронами, а медная пластина, отдавая электроны, сохраняет положительный заряд и покрывается пузырьками водорода. Во внешней части цепи происходит движение электронов от цинковой пластины к медной, внутри электролита отрицательные ионы движутся от меди к цинку, а положительные ионы — от цинка к меди. Показания амперметра, включенного в цепь работающего медно-цинкового элемента, быстро уменьшаются. Это объясняется тем, что медная пластина совместно с водородом, который покрывает эту пластину, образует своеобразную гальваническую пару, своего рода особый элемент, э. д. с. которого направлена против
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 1717; Нарушение авторских прав?; Мы поможем в написании вашей работы!