
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические методы изучения ультраструктуры биологических мембран
|
|
|
|
Оптическая и электронная микроскопия. Наблюдать структуру мембраны в обычный оптический микроскоп нельзя. Чтобы это понять, вспомним, что такое предел разрешения микроскопа Z. Это минимальное расстояние между двумя точками, изображение которых еще можно увидеть разделенными, то есть воспринимаются в микроскопе как две точки. Естественно, что чем меньше Z, тем качественнее прибор, так как позволяет видеть белее мелкие структуры. Предел разрешения оптического микроскопа Z=0,5 λ/n sin (u/2). Для грубой оценки предела разрешения оптического микроскопа будем считать n sin (u/2)=1. Тогда Zопт ≈ λ /2.
В качестве λ для оценки подставим в формулу минимальное значение длины волны видимого света (λ ≈ 400 нм) и получим для предела разрешения
Z ≈ 200 нм. Эта величина примерно в 20 раз больше толщины мембраны, поэтому о ее наблюдении в оптический микроскоп не может быть и речи. В связи с этим обстоятельством для исследования структуры мембран используется электронный микроскоп, предел разрешения которого определяется длиной волны де Бройля для движущихся с высокой скоростью электрона:
λБ = h/mv,
где h – постоянная Планка; m – масса электрона; v – скорость электрона. Предел разрешения электронного микроскопа может достигать Z≈ 0,1 нм.
Для исследования мембран используются методы замораживания – скалывания и замораживания – травления. Препараты быстро замораживают, не подвергая их каким-либо повреждающим воздействиям, как при получении тонких срезов. Подготовка препарата включает ряд операций. После замораживания образец, представляющий собой суспензию клеток, скалывают с помощью ножа при низкой температуре (-1000С) в глубоком вакууме. При скалывании образуется срез, проходящий через образец. Оказалось, что если плоскость среза проходит через мембрану, она раскалывается преимущественно по срединной области и расщепляется на две половинки. На образовавшихся плоскостях скола обнажается внутренняя область мембран.
При необходимости образец подвергают травлению и проводят обычную возгонку льда в вакууме. Это позволяет лучше визуализировать поверхностные структуры клеточных мембран.
После этого получают так называемую «реплику» с обнаженной поверхности. Эту «реплику» и изучают методом электронной микроскопии. Для получения «реплики» сначала напыляют на образец платину под углом около 450, чтобы выявить топологические характеристики препарата. Затем платиновой реплике придают механическую прочность, нанося на нее слой углерода. После этого препарат оттаивают, «реплика» всплывает и ее вылавливают с помощью специальной сеточки.
Метод дифракции рентгеновского излучения (рентгеноструктурный анализ). Использование рентгеновского излучения для анализа мембранных структур обусловлено тем обстоятельством, что одним из главных условий проявления дифракции является сопоставимость размеров объекта, на который направляется излучение, и длины волны этого излучения. Для анализа объектов нанометрового диапазона необходимо рентгеновское излучение (напомним, диапазон длин его волн от 10-5 до 80 нм).
Чтобы понять принцип использования рентгеновского излучения для анализа структуры вещества, рассмотрим структуру, на две соседние кристаллографические плоскости которой падают параллельные лучи (рис.1), которые отражаются от соседних атомов кристаллической решетки, а затем интерферируют, собираясь в одну точку на некотором экране.
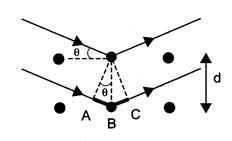
Рис. 1
Межатомное расстояние равно d, угол скольжения рентгеновских лучей - θ, Разность хода лучей ∆ = ED + DF = 2dsin θ. Если эта разность хода равна целому числу длин волн (условие Вульфа-Брегга: 2.d·sin θ = n λ (n= 0,1,2 …)), то будет наблюдаться максимум интерференции.
Наблюдая картину дифракции на экране, можно установить, под каким углом θ наблюдается, например, максимум первого порядка (n=1). Зная длину волны, можно найти важнейший параметр структуры исследуемого вещества – межатомное расстояние d:
d = n λ / 2sin θ
Рентгеноструктурный анализ подтвердил бислойное расположение фосфолипидов в мембранах и присутствие в них белков, вычислены важные структурные параметры мембраны.
Люминесцентные методы исследования мембран.
Эти методы связаны с использованием флюоресцентных меток - флюоресцирующих молекулярных групп, тем или иным способом связанных с исследуемыми молекулами и позволяющих визуализировать многие процессы.
Флюоресцентный анализ дает возможность исследовать подвижность фосфолипидных молекул в мембране, оценить вязкость липидной фазы мембраны (микровязкость).
Электронный парамагнитный резонанс. (ЭПР)
Электронный парамагнитный резонанс – это явление резкого возрастания поглощения энергии электромагнитной волны системой парамагнитных частиц (электронов с некомпенсированными спинами), помещенных во внешнее магнитное поле, при резонансной частоте волн νрез.
Так как молекулы фосфолипидов диамагнитны, то для ЭПР – исследований биомембран используются спин-зонды и спин-метки – молекулы или молекулярные группы с неспаренными электронами.
Парамагнитные спин-зонды вводят в липидную мембрану, спектры поглощения спин-зондами электромагнитной волны дают информацию о свойствах липидного окружения, в частности о подвижности липидных молекул в мембране.
Несмотря на ценную информацию, которую удалось получить при исследовании биологических объектов методом ЭПР с использованием спиновых зондов, этот метод обладает существенным недостатком – внесения в биологический объект чужеродных молекул-зондов может изменять структуру объекта. От этого недостатка свободен метод ЯМР.
Ядерный магнитный резонанс ( ЯМР ) – это явление резкого возрастания поглощения энергии электромагнитной волны системой атомных ядер, обладающих магнитным моментом, при их помещении во внешнее постоянное магнитное поле и облучении электромагнитной волной определенной (резонансной) часты.
ЯМР широко используется для исследования структуры, как простейших молекул неорганических веществ, так и сложнейших молекул живых объектов; для изучения особенностей протекания химических реакций.
Использование ЯМР-метода в медицине чрезвычайно перспективно. Этот метод неинвазивен и очень чувствителен.
3. Молекулярная структура биологических мембран. Структурную основу любой мембраны составляет двойной фосфолипидный слой (рис. 2).
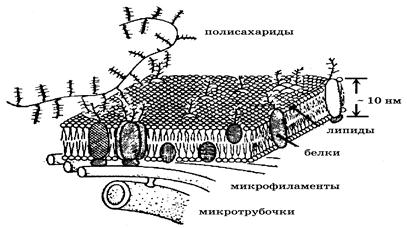
Рис. 2
Липиды (вещества на основе жирных кислот) построены из полярной головки (содержащей атомы водорода, углерода, азота, фосфора) и двух длинных неполярных углеводородных «хвостов».
Полярные головки гидрофильны, то есть могут притягивать к себе дипольные молекулы воды.
«Хвосты» обладают гидрофобными свойствами, то есть не любят взаимодействовать с водой.
В водном растворе молекулы фосфолипидов самопроизвольно собираются и образуют двойной слой (бислой), при этом гидрофильные головы располагаются на обращенных к воде поверхностях, а гидрофобные «хвосты» направлены друг к другу и вытесняют из внутренней области молекулы воды. Толщина липидного бислоя составляет примерно 4-5 нм.
Гидрофильные головки взаимодействуют с внешними белковыми слоями и молекулами воды вне и внутри клетки и образуют с ними водородные связи.
Двойной фосфолипидный слой выполняет функцию барьера и матрицы для различных белков. Липиды и белки в бислое могут перемещаться: достаточно быстро внутри слоя вдоль плоскости мембраны (латеральная диффузия) и очень медленно между двумя монослоями поперек мембраны (флип-флоп переходы).
В липидную матрицу встроены белки и функциональные белковые комплексы. Белки как бы плавают в липидном слое.
Поверхностные белки (ПБ). Эти белки могут находиться либо на внешнем, либо на внутреннем липидном монослое, удерживаясь преимущественно электростатическими силами. Такие белки занимают 75 - 80 % поверхности. Белковые поверхности покрывают мембрану с обеих сторон и придают ей эластичность и устойчивость к механическим повреждениям.
Интегральные белки (ИБ). Эти белки могут пронизывать двойной слой липидов насквозь. Такие белки являются главными компонентами ответственными за избирательную проницательность клеточной мембраны. Некоторые из них образуют систему селективных каналов (пор) или функционируют как ионные насосы и регулируют, например, электрохимическую систему возбуждения клетки. Диаметр каналов составляет 0,35 – 0,8 нм.
В первом приближении бислойную мембрану можно представить в виде такой пластины из непроводящего материала, разделяющей два водных раствора. Иначе говоря, мембрана является обычным плоским конденсатором, в котором электрические заряды расположены на двух границах раздела фаз мембрана – вода. Его электроемкость находят по формуле:
с = (ε ε0 S)/d, где
ε – диэлектрическая проницаемость диэлектрика между пластинами
конденсатора,
ε0 - электрическая постоянная (8,85.10-12 Кл.В-1м-1),
S – площадь пластин;
d – расстояние между пластинами.
Удельной электроемкостью называют отношение:
с /S = (ε ε0) /d;
Для фосфолипидных бислоев и биомембран измеряемые значения удельной электроемкости равны примерно 1 мкФ/см2, что при диэлектрической проницаемости ε ≈ 2 соответствует расстоянию между головами фосфолипидных молекул на различных поверхностях бислоя около 3,5 нм.
Электрическое сопротивление мембраны довольно велико и зависит от типа, числа ионных каналов и для разных мембран меняется в довольно широких пределах (106 - 108 Ом .см2).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 3008; Нарушение авторских прав?; Мы поможем в написании вашей работы!