
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень окисления
|
|
|
|
Классификация химических реакций
Современный подход к классификации оснований и кислот
Взаимосвязь между классами веществ
Между классами веществ существует возможность их взаимного превращения: из простых веществ получают оксиды, из оксидов – основания или кислоты, из кислот – соли. Возможен и обратный переход от солей к основаниям или кислотам, от оснований или кислот к оксидам, а от оксидов к простым веществам.
Пример 1. Напишите уравнения реакций для осуществления цепочки превращений:
Ca ® CaO ® Ca(OH)2 ® CaSO4
Решение.
1) 2Ca + O2 = 2CaO 2) CaO + H2O = Ca(OH)2 3) Ca(OH)2 + H2SO4 = CaSO4¯ + H2O
Пример 2. Напишите уравнения реакций для осуществления цепочки превращений:
P ® P4O10 ® H3PO4 ® KН2PO4 ® K2НPO4 ® K3PO4
Решение.
1) P4 + 5O2 = P4O10 2) P4O10 + 6H2O = 4H3PO4
3) H3PO4 + KOH = KН2PO4 4) KН2PO4 + KOH = K2НPO4 5) K2НPO4 + KOH = K3PO4
Пример 3. Напишите уравнения реакций для осуществления цепочки превращений:
CuSO4 ® Cu(OH)2 ® CuO ® Cu
Решение.
1) CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4
2) Cu(OH)2 = CuO + H2O 3) CuO + H2 = Cu + H2O
Подобная связь классами соединений, позволяющая получать вещество одного класса из вещества другого класса, называется генетической. Но необходимо иметь в виду, что не всегда одно вещество из другого можно получить напрямую. Например, гидроксид меди Cu(OH)2 нельзя получить взаимодействием оксида меди (II) с водой. Тогда применяют косвенный путь: на оксид меди (II) действуют кислотой и получают соль, а из соли действием щелочи получают гидроксид меди (II).
Генетическая связь между основными классами веществ показана на рис. 5.

Рис.5. Генетическая связь между основными классами неорганических веществ
Химия, как и вся наука, быстро развивается. По мере её развития пересматриваются многие понятия. Пересматриваются взгляды и на классификацию неорганических соединений.
В настоящее время основания и кислородсодержащие кислоты рассматриваются как соединения одного класса – гидроксиды, т.е. продукты присоединения воды к оксидам (дословно: водные оксиды). Современное определение таково.
Гидроксиды – химические соединения оксидов с водой. Гидроксиды многих металлов – основания, а неметаллов– кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными.
Все гидроксиды имеют в своём составе один или несколько атомов кислорода, которые одновременно связаны с атомами водорода и элемента. Общая формула простейших гидроксидов ЭОН. Деление гидроксидов на основания и кислоты определяется их диссоциацией при растворении в воде. Характер диссоциации зависит от сравнительной прочности и полярности связей Э–О и О–Н и может протекать по двум типам:
1) ЭОН = Э+ + ОН– – по типу оснований, 2) ЭОН = Н+ + ЭО– – по типу кислот.
Гидроксиды, в которых связь Э–О сильно полярна и имеет небольшую прочность, диссоциируют по первому типу – это типичные основания. Гидроксиды, в которых связь Э–О обладает небольшой полярностью, но большей, чем связь О–Н, прочностью, диссоциируют как кислоты. Но у многих гидроксидов обе связи мало отличаются по степени полярности и по прочности, поэтому они диссоциируют одновременно по обоим типам – это амфотерные основания или амфолиты.
Тип диссоциации гидроксида зависит от валентности (степени окисления) элемента. С увеличением валентности связь Э–О упрочняется, а связь О–Н ослабевает. Поэтому кислотные свойства гидроксидов усиливаются в периодах периодической системы:
| NaOH Mg(OH)2 | Al(OH)3 Si(OH)4 | H3PO4 H2SO4 HClO4 |
| о с н о в а н и я | а м ф о л и т ы | к и с л о т ы |
ослабевают в группах:
| Н3ВО3 | Al(OH)3 Ga(OH)3 In(OH)3 | Tl(OH)3 |
| кислота | а м ф о л и т ы | основание |
а у гидроксидов одного элемента усиливаются при увеличении его валентности:
| Mn(OH)2 Mn(OH)3 | Mn(OH)4 | H2MnO4 HMnO4 |
| о с н о в а н и я | амфолит | к и с л о т ы |
Общая схема классификации неорганических соединений на три (а не четыре) основных класса (оксиды, гидроксиды, соли) приведена на рис. 6.
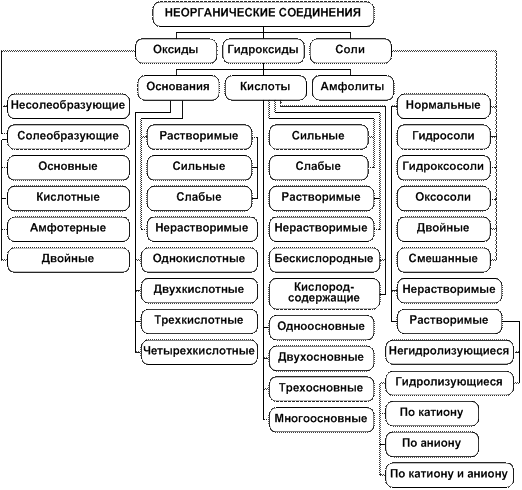
Рис. 6. Современная классификация неорганических соединений
Тема 3. Окислительно-восстановительные реакции
По этой теме необходимо знать и уметь следующее.
1.(15). Определять степень окисления элементов в любом соединении, отличать ОВР от реакций, протекающих без изменения степени окисления элементов.
2.(16). Находить в ОВР окислитель, восстановитель и среду.
3.(17). Устанавливать тип ОВР: межмолекулярная, внутримолекулярная, диспропорционирование, конпропорционирование.
4.(18). Определять стехиометрические коэффициенты методом электронного баланса.
5.(19). Вычислять эквивалентные массы восстановителей и окислителей.
По этой теме проводится лабораторная работа, в ходе которой студенты самостоятельно проводят несколько интересных окислительно-восстановительных реакций. Теоретический материал этой темы включает следующие элементы содержания.
1. Классификация химических реакций
2. Степень окисления
3. Окислительно-восстановительные реакции
4. Окислители и восстановители
5. Окислительно-восстановительная двойственность
6. Классификация окислительно-восстановительных реакций
7. Уравнения окислительно-восстановительных реакций
8. Реакции с участием пероксидов
9. Эквиваленты восстановителей и окислителей
Химические превращения одних веществ в другие называется химическими реакциями. Химические реакции классифицируются по разным признакам. В каждом разделе химии используется своя классификация реакций, необходимая при изучении тех или иных закономерностей их протекания. Например, в термохимии реакции подразделяются на экзотермические и эндотермические, в химической термодинамике – на самопроизвольные и не самопроизвольные, в химической кинетике – на простые и сложные. При изучении растворов рассматриваются ионообменные реакции и реакции гидролиза, а при изучении электрохимических процессов – токообразующие реакции в химических источниках электроэнергии и реакции электролиза.
Но в начале изучения химии необходимо усвоить две самые общие классификации химических реакций: 1) по изменению состава продуктов по сравнению с составом реагентов и 2) по изменению степени окисления элементов.
По первому признаку (по изменению состава продуктов по сравнению с составом реагентов) химические реакции подразделяются на реакции соединения, разложения, замещения и обмена.
В реакциях соединения из двух или нескольких веществ образуется одно новое вещество:
Mg + Cl2 = MgCl2; NH3 + HCl = NH4Cl; CaO + H2O = Ca(OH)2
В реакциях разложения, наоборот, из одного вещества образуются несколько новых веществ, например:
2H2O2 = 2H2O + O2;
CaСO3  CaO + CO2 (эта реакция протекает при 900 ºС)
CaO + CO2 (эта реакция протекает при 900 ºС)
В реакциях замещения атомы простого вещества замещают атомы одного из элементов сложного вещества, например:
2NaBr + Cl2 = 2NaCl + Br2; Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
В реакциях обмена два вещества обмениваются своими составными частями, образуя два новых вещества, например:
H2SO4 + Ba(OH)2 = BaSO4¯ + 2H2O; CaCl2 + 2AgNO3 = Ca(NO3)2 + AgCl¯
По второму признаку (по изменения степени окисления элементов), входящих в состав реагентов, различают реакции, протекающие без изменения и с изменением степеней окисления. К реакциям без изменения степеней окисления атомов относятся все реакции обмена и гидролиза (они рассматриваются в разделе «Растворы»), многие реакции разложения и некоторые реакции соединения. Реакции, протекающие с изменением степеней окисления атомов, называются окислительно-восстановительными реакциями. Далее эти реакции рассматриваются подробно.
В окислительно-восстановительных реакциях происходит изменение степени окисления некоторых (иногда всех) элементов, входящих в состав реагентов, поэтому вначале рассмотрим понятие степень окисления. Известно три определения этого понятия.
Самое распространённое определение: степенью окисления элемента называется условный заряд его атома, вычисленный из предположения, что вещество состоит из ионов.
Это определение имеет тот недостаток, что, несмотря на оговорку об условности, невольно закрепляет неправильное представление об ионном строении веществ. В действительности чисто ионных связей не бывает, а реальные заряды атомов в веществах (эффективные заряды) далеко не равны их степеням окисления.
Второе определение: степенью окисления элемента в веществе называется его стехиометрическая валентность, взятая со знаком плюс или минус в соответствии с общепринятым делением элементов на электроположительные (знак плюс) и электроотрицательные (минус).
Это определение наиболее точно выражает сущность понятия, но встречаются соединения, в которых трудно определить знак степени окисления элемента, например, соединения двух неметаллов. В таких случаях сравнивают электроотрицательность элементов, входящих в состав данного соединения. Электроотрицательность характеризует свойство атомов притягивать валентные электроны. Она выражается относительным числом в шкале, в которой за единицу принята электроотрицательность лития. В справочнике (пособие 10) приведены электроотрицательности химических элементов. Электроотрицательность является периодическим свойством; у элементов главных подгрупп в периодах увеличивается, например: Li(1,0) – Be(1,5) – B(2,0) – C(2,5) – N(3,0) – O(3,5) – F(4,0), а в группах уменьшается, например: F(4,0) – Cl(3,0) – Br(2,8) – I(2,5).
У элементов побочных подгрупп (все они являются металлами) электроотрицательность равна 1,5 – 1,8. Электроотрицательность водорода равна 2,1.
В бинарных (состоящих из двух элементов) соединениях элемент с большей электроотрицательностью имеет отрицательное значение степени окисления, а его партнер по химической связи – положительное. Например, в оксиде серы (IV) SO2 сера имеет меньшую, чем кислород, электроотрицательность, поэтому степень окисления серы, равная её валентности, имеет положительный знак (+4), а степень окисления кислорода – отрицательный (–2).
Ещё одно определение: степенью окисления элемента в веществе называется число электронов, смещенных от атома этого элемента (при положительной степени окисления), или к атому этого элемента (при отрицательной степени окисления), вследствие поляризации химической связи.
Для уяснения этого понятия необходимо знать электронное строение атомов и механизм образования и поляризации химических связей; эти вопросы в следующей лекции.
Степень окисления элемента определяется по правилам, которые являются следствием рассмотренных определений этого понятия.
1. В простых веществах степень окисления элементов равна нулю.
2. Водород в большинстве соединений имеет степень окисления +1, но в соединениях с металлами (гидридах) она равна – 1.
3. Кислород в большинстве соединений находится в степени окисления - 2, но в пероксидах его степень окисления равна – 1.
4. Фтор во всех соединениях имеет степень окисления – 1.
5. Металлы в соединениях имеют положительную степень окисления, причем, щелочные металлы всегда +1, металлы второй группы (кроме ртути) всегда +2, алюминий всегда +3.
6. Алгебраическая сумма степеней окисления всех атомов в молекуле или формульной единице вещества равна нулю, а в ионе – заряду иона.
Степень окисления указывается над символом атома цифрой со знаком плюс или минус впереди, например:
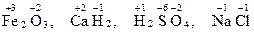 .
.
Примечание. Степень окисления следует отличать от заряда иона, который указывается в верхнем индексе справа цифрой со знаком после цифры (но цифра 1 не ставится), например: Fe2+, Cl–, SO42–, NH4+.
Пример 1. Определите степень окисления серы в соединениях SO2, SO3 и H2S.
Решение. Степень окисления водорода (+1) и кислорода (–2) известны. Руководствуясь правилом 6, определяем степень окисления серы: она равна +4 (SO2), +6 (SO3) и –2(H2S)
Пример 2. Определите степень окисления марганца в в соединениях MnO2 и KMnO4.
Решение. В соединении MnO2 степень окисления марганца определяется довольно просто (по кислороду): +4. Что касается перманганата калия, то здесь необходимо составить и решить несложное алгебраическое уравнение:
+1 + х – 8 = 0; х – 7 = 0; х = +7
Полученное число является степенью окисления марганца в этом соединении.
Пример 3. Определите степень окисления хрома в в соединениях K2CrO4, K2Cr2O7 и Cr2(SO4)3.
Решение. Обозначив неизвестную степень окисления хрома буквой х, составляем и решаем не сложные алгебраические уравнения.
1) K2CrO4: +2 + x – 8 = 0; x = +6.
2) K2Cr2O7: +2 + 2x – 14 = 0; 2x = 12; x = +6.
3) Cr2(SO4)3: 2x + 3·(+6) + 12·(–2) = 0; 2x + 18 – 24 = 0; 2x = 6; x = +3.
Таким образом, в двух первых соединениях степень окисления хрома равна +6, а в третьем она равна +3.
Пример 4. Определите степень окисления элементов в соединениях PCl5, NH3, PH3 и AsH3.
Решение. Численные значения степеней окисления равны валентности элементов, а знаки степеней окисления определяются по их электроотрицательности.
Первое соединение PCl5: хлор – более электроотрицательный элемент (его электроотрицательность равна 2,83), чем фосфор (2,06), поэтому степень окисления хлора равна –1, а фосфора +5.
Второе соединение NH3: электроотрицательность азота равна 3,07, а водорода 2,20, поэтому степень окисления азота равна –3, а водорода +1; формулу этого соединения (это аммиак) следует записывать H3N, но исторически сложилось так, что формулу аммиака записывают неверно: NH3
Третье соединение PH3: электроотрицательность фосфора (2,06) меньше, чем водорода (2,20), поэтому степени окисления элементов равны +3 и –1; формула соединения (это фосфин) записана правильно.
Четвертое соединение AsH3: электроотрицательности по шкале Олреда-Рохова мышьяка и водорода одинаковые (2,20), поэтому их степени окисления равны нулю. Но по шкале Полинга водород более электроотрицательный (2,1), чем мышьяк (2,0), поэтому степень окисления элементов в этом соединении равны +3 (As) и –1 (H); формула AsH3 – правильная, соединение называется арсин.
Пример 5. Определите степень окисления азота в соединениях NH4NO3 и NH4NO2.
Решение. В формульной единице каждого из этих соединений имеется по два атома азота в различных степенях окисления. Первый атом в обоих соединениях входит в состав катиона аммония NH4+ и степень его окисления равна –3. Другой атом азота в первом соединении входит в состав нитрат-иона NO3–, поэтому степень его окисления равна +5, а во втором соединении – в состав нитрит-иона NO2– , поэтомустепень его окисления равна +3.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2812; Нарушение авторских прав?; Мы поможем в написании вашей работы!