
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура кислот
|
|
|
|
Состав и классификация кислот
Кислоты
Кислотами называются вещества, при электролитической диссоциации которых в водных растворах в качестве катионов образуются только катионы водорода H+ и никаких других катионов не образуется.
Анионы, образующиеся при диссоциации кислот, называются кислотными остатками.
Диссоциация многих кислот протекает необратимо; в этом случае в схеме диссоциации ставится знак равенства. Но ряд кислот диссоциирует обратимо; в этом случае в схеме диссоциации ставится знак обратимости
HCl = H+ + Cl– – кислотный остаток хлорид-анион
HNO3 = H+ + NO3– – кислотный остаток нитрат-анион
HСN D H+ + СN– – кислотный остаток цианид-анион
Кислоты классифицируются по составу кислотного остатка (по содержанию в них кислорода), количеству катионов водорода в одном моле кислоты (которые могут замещаться атомами металлов), по растворимости в воде и по силе.
По составу кислотного остатка кислоты подразделяются на бескислородные (HF, HCl, HBr, HI, H2S, HCN и т.д.) и кислородосодержащие (HNO3, H2SO4, HClO4, H3PO4, H2SiO3 и т.д.)
Многие свойства кислот определяются концентрацией катионов водорода в их растворах, которая зависит от полноты диссоциации молекул. Кислоты, диссоциирующие практически нацело, называются сильными, а кислоты, диссоциирующие обратимо, – слабыми. Наиболее распространённые сильные кислоты – это HCl, HBr, HI, HNO3, H2SO4, HClO3, HClO4, а наиболее часто встречающиеся слабые кислоты – это HNO2, H2SO3, H2S, HClO, HClO2, HCN и органическая уксусная кислота CH3COOH. Принято считать, что все кислоты – растворимые в воде соединения. Действительно, растворимых кислот большинство, но встречаются и малорастворимые кислоты, например H2SiO3, H2SnO3, H3BO3. Классификация кислот показана на рис. 3.
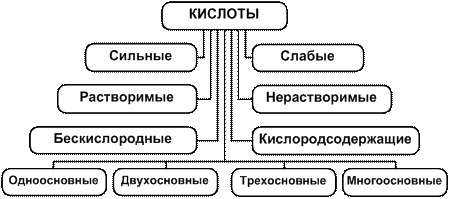
Рис. 3. Схема классификации кислот
По количеству катионов водорода кислоты подразделяются на одноосновные (HCl, HNO3, HClO3), двухосновные (H2S, H2SO4, H2CO3) и многоосновные (H3PO4, H4SiO3, H6TeO6).
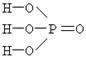
У большинства кислот их основность равна числу атомов водорода в молекуле. Но встречаются кислоты, в которых основность меньше числа атомов водорода. Например, в молекуле фосфорной кислоты H3PO4 содержится три атома водорода и её основность равна трём, т.к. при диссоциации из одной молекулы образуются три катиона водорода:
H3PO4 D 3H+ + PO43–
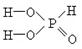
В молекуле фосфористой кислоты H3PO3 содержится также три атома водорода, но основность её равна двум, так как при диссоциации образуются не три, а только два катиона водорода:
H3PO3 D 2H+ + HPO32-
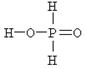
Третий пример – фосфорноватистая кислота H3PO2, которая, несмотря на наличие трёх атомов водорода в её молекуле, является одноосновной. Её диссоциация в воде идёт с образованием только одного катиона водорода по схеме:
H3PO2 D H+ + H2PO2–
Различие основности этих кислот объясняется тем, что в молекуле H3PO4 атомы водорода по своим химическим связям с другими атомами равноценны – каждый из них соединен с атомом кислорода. В молекулах H3PO3 и H3PO2 атомы водорода по химическим связям с другими атомами не равноценны: в первой из них два атома соединены с атомами кислорода, а один – с атомом фосфора, а во второй только один атом водорода соединяется с атомом кислорода, а два – с атомом фосфора. Это различие хорошо видно при сравнении структурных формул кислот.
| Ортофосфорная H3PO4 | Фосфоритая H3PO3 | Фосфорноватистая H3PO2 |
|
|
|
При диссоциации молекул происходит разрыв полярных связей H – O, а практически неполярная связь Р – Н не разрывается. Поэтому H3PO4 – трёхосновная кислота, H3PO3 – двухосновная, а H3PO2 – одноосновная.
Примечание. Следует иметь в виду, что заряд кислотного остатка – аниона, образующегося при диссоциации кислоты, равен основности этой кислоты.
Названия бескислородных кислот начинаются с названия неметалла с окончанием -о и прибавлением слова водородная: HF – фтор о водородная, HCl – хлор о водородная, HBr – бром о водородная, H2S – сер о водородная. Кислота HCN имеет название циан о водородная.
Названия кислородосодержащих кислот производятся от русских названий кислотоообразующих элементов с различными суффиксами, которые необходимо строго выдерживать.
Если элемент образует две кислоты, то используются суффиксы - н и - ист: первый – при максимальной валентности кислотообразующего элемента, а второй, если валентность не максимальная.
+6 +4
H2SO4 – сер н ая кислота, H2SO3 – серн ист ая кислота;
+5 +3
HNO3 – азот н ая кислота, HNO2 – азот ист ая кислота.
В названиях некоторых кислот суффикс -н заменяется суффиксами - ов и -ев: H2CrO4 – хром ов ая кислота, H2SiO3 – кремни ев ая кислота.
Галогены хлор, бром и йод, кроме бескислородных, образуют по четыре кислородосодержащих кислоты при валентности VII, V, III и I. В названиях этих кислот используются, по мере понижения валентности, суффиксы -н, -оват, -ист и -оватист: HClO4 – хлор н ая, HClO3 – хлорн оват ая, HClO2 – хлор ист ая, HClO – хлорн оватист ая.
Существуют кислоты, образованные одним и тем же элементом в одной и той же степени окисления, но состав их различен. В этом случае к названию кислоты с наименьшим содержанием атомов водорода и кислорода добавляется префикс (приставка) мета -, с наибольшим орто -, а при промежуточном содержании атомов водорода и кислорода (в расчёте на один атом кислотообразуещего элемента) – пиро-: HPO3 – мета фосфорная кислота, H3PO4 – орто фосфорная кислота, H4P2O7 – пиро фосфорная кислота.
В справочнике приведены формулы и названия 38 наиболее распространённых кислот.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2070; Нарушение авторских прав?; Мы поможем в написании вашей работы!