
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура оснований
|
|
|
|
Состав и классификация оснований
Основания
Основаниями называются сложные вещества, в состав которых входят атомы металлов, соединённые с одной или несколькими гидроксогруппами: NaOH, Ca(OH)2, Cr(OH)3 и т.д. Но это определение исключает из класса оснований гидрат аммония NH3∙H2О, поэтому лучше пользоваться определением на основе теории электролитической диссоциации: основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы:
NaOH = Na+ + OH–; NH3∙H2О D NH4+ + OH–
Примечание. Гидрат аммиака часто записывают как гидроксид аммония NH4OH, но это неправильно, т.к. доказано, что такое соединение не существует.
По растворимости к воде основания подразделяются на растворимые и нерастворимые. К растворимым относятся основания щелочных металлов (NaOH, KOH и др.), щелочноземельных (Ca(OH)2, Ba(OH)2 и др.) и гидрат аммиака NH3∙H2О. Свойства этих оснований определяются концентрацией в их растворах гидроксид-ионов. Гидроксиды щелочных и щелочноземельных металлов – сильные электролиты. Их диссоциация в водных растворах протекает практически необратимо, концентрация OH– -ионов в растворах велика, поэтому растворы мыльные на ощупь, они разъедают кожу, изменяют окраску индикаторов называются щелочами. Гидрат аммиака – слабый электролит, его диссоциация обратима, поэтому концентрация OH–-ионов в растворах этого основания невелика, но достаточна для изменения цвета индикаторов. Остальные основания практически нерастворимы в воде, ионы OH– в их растворах практически отсутствуют, поэтому цвет индикаторов в них не изменяется.
По взаимодействию с другими веществами основания подразделяются на типичные и амфотерные. Типичными являются те основания, которым соответствуют оснóвные оксиды: это все щёлочи, а также Mg(OH)2, La(OH)3, Mn(OH)2, Bi(OH)3 и др. Амфотерными являются те основания, которым соответствуют амфотерные оксиды. Это Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Sn(OH)2, Sn(OH)4, Pb(OH)2, Pb(OH)4, Mn(OH)4 и др.
Необходимо иметь в виду ещё одну классификацию оснований – по числу гидроксогрупп в составе одной формульной единице. Основания с одним гидроксид-ионом называются однокислотными, с двумя – двухкислотными, с тремя – трёхкислотными и с четырьмя – четырёхкислотными. Классификация оснований представлена в кратком виде на рис. 2.
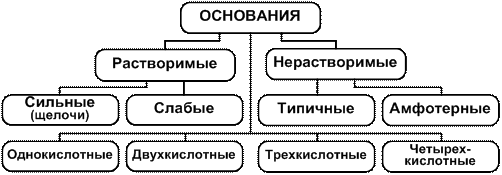
Рис. 2. Схема классификации оснований
Примечание. Кислотность основания равна количеству одноосновной кислоты, затрачиваемой на реакцию с одним молем данного основания. На взаимодействие с одним молем однокислотного основания требуется один моль одноосновной кислоты:
NaOH + HCl = NaCl + H2O
Если основание двухкислотное, то требуется два моля кислоты:
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
А если в реакции участвует один моль трёх- или четырёхкислотного основания, то затрачивается три или четыре моля кислоты:
Al(OH)3 + 3HCl = AlCl3 + 3H2O; Sn(OH)4 + 4HCl = SnCl4 + 4H2O
Названия оснований состоят из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия, Ba(OH)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия т.д. Если металл образует несколько оснований, то указывается валентность (степень окисления) металла римской цифрой в скобках после названия: Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III), Sn(OH)2 – гидроксид олова (II), Sn(OH)4 – гидроксид олова (IV) и т.д.
Несуществующее основание NH4OH называется гидроксидом аммония (NH4+ – катион аммония).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2744; Нарушение авторских прав?; Мы поможем в написании вашей работы!