
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура оксидов
|
|
|
|
Состав и классификация оксидов
Оксиды
Оксидами называются сложные вещества, которые состоят из двух элементов, одним из которых является кислород в степени окисления –2.
По составу и кислотно-оснóвным свойствам оксиды подразделяются на солеобразующие (оснóвные, кислотные, амфотерные) и несолеобразующие.
Оснóвные – это оксиды, которым соответствуют типичные основания, например: Na2O (соответствует основание NaOH), BaO (основание Ba(OH)2), La2O3 (основание La(OH)3) и т.д.
Кислотные – это оксиды, которым соответствуют кислоты, например: SO3 (соответствует кислота H2SO4), CO2 (кислота H2CO3), SiO2 (кислота H2SiO3), CrO3 (кислота H2CrO4) и т.д.
Амфотерные – это оксиды, которым соответствуют амфотерные основания, например: ZnO (амфотерное основание Zn(OH)2), Al2O3 (амфотерное основание Al(OH)3), SnO2 (амфотерное основание Sn(OH)4) и т.д.
Из оснóвных, кислотных и амфотерных оксидов можно получать соли, поэтому их называют солеобразующими. Почти все оксиды – солеобразующие. Но имеется небольшая группа оксидов, которые солей не образуют, у них нет соответствующих кислот и оснований. Они называются несолеобразующими («безразличными»). К ним относятся оксиды CO, NO, N2O.
Классификация оксидов в наглядной схематической форме приведена на рис. 1.
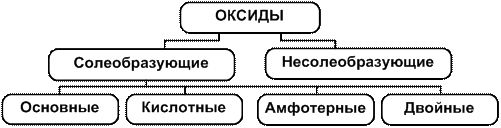
Рис. 1. Схема классификации оксидов
С учётом деления химических элементов на металлы и неметаллы можно сказать, что неметаллы образуют кислотные и несолеобразующие оксиды. Что касается металлов, то принадлежность их оксидов к тому или иному классу определяется валентностью (степенью окисления) металла: чем она больше, тем сильнее выражены кислотные свойства. Так, например все оксиды одновалентных металлов (Na2O, K2O, Li2O и др.) – оснóвные, кроме оксидов серебра Ag2O и меди Cu2O, которые обладают слабыми амфотерными свойствами. Часть оксидов двухвалентных металлов – оснóвные (MgO, CaO, BaO, MnO и др.), а часть – амфотерные (ZnO, BeO, SnO, PbO и др.). Среди оксидов трёхвалентных металлов оснóвные встречаются редко (La2O3, Bi2O3, Tl2O3), т.е. большинство их – амфотерные (Al2O3, Cr2О3, Fe2O3 и др.). Оксиды четырёхвалентных металлов все амфотерные (SnO2, PbO2, MnO2, TiO2 и др.), а при валентности металла выше четырёх оксиды всех металлов являются кислотными(V2O5, CrO3, Mn2O7 и др.).
Названия оксидов состоят из двух слов: первое слово «оксид» – производное от латинского названия кислорода (oxygenium), а второе – русское название элемента в родительном падеже. Если элемент образует несколько оксидов, то указывается его валентность (степень окисления) римской цифрой в скобках после названия элемента. Примеры: Na2O – оксид натрия, CaO – оксид кальция, Al2O3 – оксид алюминия, FeO – оксид железа (II), Fe2O3 – оксид железа (III), N2O5 – оксид азота (V).
Если элемент имеет чётную валентность, то в названии его оксида число атомов кислорода может быть указано греческими названия чисел 1 (моно), 2 (ди), 3 (три) и 4 (тетра), которые вводятся в виде префикса к слову «оксид»; при этом валентность не указывается. Примеры: СО – монооксид углерода, СО2 – диоксид углерода, SO3 – триоксид серы.
Кислотные оксиды в отечественной литературе часто называются ангидридами соответствующих кислот: SO3 – серный ангидрид, SO2 – сернистый ангидрид, P2O5 – фосфорный ангидрид, N2O3 – азотистый ангидрид, N2O5 – азотный ангидрид. Слово «ангидрид» переводится как «безводный», следовательно, подобное название оксида SO3 дословно означает «безводная серная кислота», P2O5 – «безводная фосфорная кислота» и т.д.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2360; Нарушение авторских прав?; Мы поможем в написании вашей работы!