
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчеты по уравнениям реакций
|
|
|
|
В уравнении химической реакции коэффициенты перед формулами – это количества веществ. Поэтому уравнение (именно уравнение, а не схема!) реакции дает не только качественную, но и количественную информацию о реакции.
Пример 15. В производстве азотной кислоты аммиак при 750 ºС окисляется в присутствии катализатора (сплав на основе платины) до оксида азота (II). Какая количественная информация заключена в уравнении соответствующей реакции?
Решение. 1) Записываем уравнение реакции, молярные массы и молярные объемы реагентов и продуктов:
4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г)
М(NH3) = 17 г/моль, М(О2) = 32 г/моль, М(NO) = 30 г/моль, М(Н2О) = 18 г/моль
Vm(NH3) = Vm(О2) = Vm(NO) = Vm(Н2О) = 22,4 л/моль
2) Уравнение реакции свидетельствует о том, что на окисление 4-х моль аммиака расходуется 5 моль кислорода и что при этом образуется 4 моль оксида азота (II) и 6 моль газообразной воды.
3) С учетом стехиометрических коэффициентов массы взаимодействующих аммиака и кислорода составляют 68 г и 160 г, соответственно, а массы образующихся оксида азота (II) и воды – 120 и 108 г., соответственно. Общая масса реагентов(228 г) и продуктов (228 г) одинаковая, что согласуется с законом сохранения массы при химических реакциях.
4) Учитывая значение молярного объема (22,4 л/моль), находим объемы реагентов и продуктов; они равны 89,6 л (NH3), 112 л (О2), 89,6 л (NO) и 134,4 л (Н2О – газ).
Обычно известна масса (или объем – для газа) одного из реагентов или продуктов, но этого достаточно, чтобы определить массы (и объемы - для газов) всех участвующих в реакции веществ.
Пример 16. Перманганат калия и сероводород в среде серной кислоты взаимодействуют согласно уравнению:
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O
Какая масса KMnO4 и какой объем H2S (при н.у.) взаимодействуют в этой реакции, если образуется 80 г серы?
Решение. 1) Молярная масса атомов серы M(S) = 32 г/моль. Находим количество серы, образующейся в результате реакции:
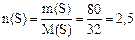 моль
моль
2) Согласно уравнению реакции, на образование 5 моль серы расходуется 2 моль KMnO4, следовательно, при образовании 2,5 моль серы в реакции участвует 1 моль KMnO4, т.е. 158,0 г.
3) По уравнению реакции количества сероводорода и серы одинаковы, следовательно, объем сероводорода можно вычислить так:
V(H2S) = n(H2S)∙Vm = 2,5∙22,4 = 56,0 л
Бывают задачи, в которых даны массы двух взаимодействующих веществ. В таких задачах необходимо вначале определить, какое вещество имеется в недостатке, и по этому веществу вести расчет продуктов реакции.
Пример 17. К раствору, содержащему 16,22 г FeCl3, прилили раствор, содержащий 14,5 г NaOH. Определить массу образовавшегося осадка Fe(OH)3.
Решение. Записываем уравнение реакции и молярные массы веществ:
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3
M(FeCl3) = 162,2 г/моль; M(NaOH) = 40,0 г/моль; M(Fe(OH)3) = 106,8 г/моль
Находим количества реагентов:
n(FeCl3) = 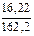 = 0,1 моль; n(NaOH) =
= 0,1 моль; n(NaOH) = 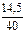 = 0,3625 моль
= 0,3625 моль
По уравнению реакции количество гидроксида натрия должно быть в три раза больше количества хлорида железа (III), но по результатам проведенного расчета оно еще больше, следовательно, FeCl3 дан в недостатке, поэтому определение массы Fe(OH)3 необходимо вести по этому веществу. По уравнению реакции количества FeCl3 и Fe(OH)3 одинаковы, следовательно, получено 0,1 моль или 10,68 г Fe(OH)3.
Стехиометрические расчеты имеют большое значение при анализе смесей и сплавов, когда с помощью химических реакций определяется их состав.
Пример 18. Для определения состава смеси нитрата натрия с хлоридом натрия 20,00 г этой смеси растворили в воде и к полученному раствору добавили в избытке раствор AgNO3. Полученный осадок промыли и высушили; масса осадка оказалось равной 2,87 г. Определить массу и массовую долю хлорида натрия в исходной смеси.
Решение. Осадок образуется в результате реакции нитрата серебра с хлоридом натрия:
NaCl + AgNO3 = NaNO3 + AgCl↓; M(NaCl) = 8,44 г/моль; M(AgCl) = 143,32 г/моль
Находим количество образовавшегося осадка хлорида серебра:
n(AgCl) = 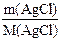 =
= 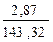 = 0,02 моль
= 0,02 моль
По уравнению реакции количества хлорида натрия и хлорида серебра одинаковые, следовательно, количество NaCl составляет 0,02 моль, а его масса равна 0,02∙58,44 г, т.е. 1,17 г.
Вычисляем массовую долю хлорида натрия в исходной смеси:
w(NaCl) = 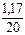 = 0,0585 = 5,85 %
= 0,0585 = 5,85 %
Пример. 19 При взаимодействии соляной кислоты с 2,20 г сплава магния с алюминием выделилось 2,33 л водорода (н.у.). Определить массовые доли алюминия и магния в сплаве.
Решение. 1) Если массу магния в сплаве принять за x, а объем выделившегося водорода за y, то масса алюминия будет равна (2,20 – x), а объем водорода, который выделяется при взаимодействии алюминия с соляной кислотой, будет равен (2,33 – y).
Записываем уравнения реакций, в которых указываем массы и молярные массы магния и алюминия, объем и молярный объем водорода:
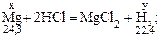
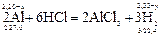
2) Составляем две пропорции:
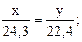
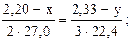
3) По пропорциям составляем систему двух уравнений с двумя неизвестными:
22,4∙x = 24,3∙y (1)
3·22,4∙(2,20 – x) = 2·27,0∙(2,33 – y) (2)
4) Выразив из первого уравнения значение неизвестного y и подставив его во второе уравнение, находим значение x, т.е. массу магния; она равна 1,26 г. Массу алюминия в сплаве находим по разности; она равна 0,94 г.
5) Вычисляем массовые доли металлов в сплаве:
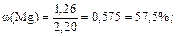
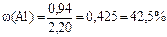
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1113; Нарушение авторских прав?; Мы поможем в написании вашей работы!