
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон эквивалентов
|
|
|
|
Закон эквивалентов относится к основным стехиометрическим законам химии, на которых основано атомно-молекулярное учение, но в школьном курсе химии он не изучается, поэтому требует специального рассмотрения.
Обычно в учебных пособиях приводится такая формулировка закона эквивалентов: массы взаимодействующих без остатка веществ относятся как их эквивалентные массы. Этой формулировке соответствует математическое выражение:
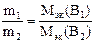
В действительности формулировка закона эквивалентов такова: вещества взаимодействуют между собой равным числом эквивалентов. А формулировка, которая обычно приводится в учебных пособиях, и её математическое выражение – это следствие закона эквивалентов.
Эквивалентом (Э) называется реальная или условная частица, которая соединяется с одним атомом или ионом водорода, либо замещает его. Реальные частицы – это атомы или молекулы, а условные – их части, например, 1/2 атома кислорода, 1/3 молекулы H3PO4 и т.д. Относительная масса такой частицы называется эквивалентной массой (Эr), а масса одного моля этих частиц (эквивалентов) – молярной массой эквивалента (Мэк). Единица измерения молярной массы эквивалента – г/моль эк.
Из определения эквивалента следует, что эквивалентная масса – относительная величина, причем, за эталон взят водород, эквивалент которого – его атом, а его эквивалентная масса равна единице, а молярная масса его эквивалента – 1 г/моль эк.
Для определения эквивалентной массы химического элемента не обязательно исходить из его соединения с водородом. Ее можно вычислить по составу соединения данного элемента с кислородом, эквивалентная масса которого в большинстве случаев равна восьми, или по составу соединения данного элемента с любым другим, эквивалентная масса которого известна.
Элементы переменной валентности образуют с другими элементами по несколько соединений разного состава, при этом их эквивалентные массы в этих соединениях будут различными. Между атомной массой (Ar), валентностью (Z) и эквивалентной массой (Мэк) элемента существует простая взаимосвязь:
Мэк = 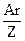
Пример 11. Мышьяк образует два оксида с массовой долей мышьяка 65,2 % и 75,7 %. Определить эквивалентную массу и валентность мышьяка в оксидах и написать формулы оксидов.
Решение. Проводим вначале все вычисления для первого оксида.
1) Принимаем массу оксида 100 г. В этом случае масса мышьяка равна 65,2 г, а кислорода 34,8 г;
2) Молярная масса эквивалентов кислорода в оксидах равна 8 г/моль эк. По закону эквивалентов вычисляем молярную массу эквивалентов мышьяка:
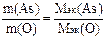 ; Мэк(As) =
; Мэк(As) =  г/моль эк
г/моль эк
3) Определяем валентность мышьяка:
Z =  ,
,
следовательно формула оксида As2O5.
4) Проводим такие же вычисления для второго оксида, получаем As2O3.
Для вычисления эквивалентной массы и численно равной ей молярной массы эквивалента химического соединения используется соотношение:
Мэк = 
в котором М – молярная масса соединения; Zэк – его эквивалентное число.
Эквивалентное число показывает, сколько эквивалентов вещества содержится в его молекуле или формульной единице. Оно зависит от реакции, в которой участвует вещество и является аналогом стехиометрической валентности химического элемента.
В обменных реакциях эквивалентное число определяется стехиометрией реакции, например:
H2SO4 + KOH = KHSO4 + H2O; Zэк(H2SO4) = 1
H2SO4 + 2KOH = K2SO4 + 2H2O; Zэк(H2SO4) = 2
Zn(OH)2 + HCl = ZnOHCl + H2O; Zэк(Zn(OH)2) = 1
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O; Zэк(Zn(OH)2) = 2
KHSO4 + BaCl2 = BaSO4 + KCl + HCl; Zэк(KHSO4) = 2
KHSO4 + KOH = K2SO4 + H2O; Zэк(KHSO4) = 1
Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4 ; Zэк(Al2(SO4)3) = 6
Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4 ; Zэк(Al2(SO4)3) = 12
В окислительно-восстановительных реакциях эквивалентное число окислителя равно числу электронов, принимаемых одной формульной единицей окислителя, а эквивалентное число восстановителя – числу отдаваемых им электронов. Например, в реакции:
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
эквивалентное число FeSO4 (восстановитель) равно 1, а K2Cr2O7 (окислитель) равно 6.
Примечание 1. Эквивалентная масса химического соединения равна сумме эквивалентных масс элементов, образующих это соединение.
Примечание 2. Существует и используется в расчётах понятие эквивалентного объёма газообразного вещества. Эквивалентный объём водорода равен 11,2 л/моль, кислорода – 5,6 л/моль
Понятие «эквивалент» и закон эквивалентов имеют большое значение в химии. Они используются при определении атомных масс химических элементов, концентрации растворов, жесткости воды и в расчетах процессов электролиза.
Пример 12. Двухвалентный металл массой 1,168 г вытеснил из серной кислоты 438 мл водорода (объём измерен при температуре 17 ºС и давлении 750 мл рт. ст.). Определить эквивалентную и атомную массу металла. Какой это металл?
Решение. 1) Переводим давление в паскали по пропорции:
101325 Па соответствует 760 мм рт. ст.
х Па соответствует 750 мм рт. ст.
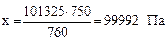
2) По уравнению Клапейрона – Менделеева вычисляем массу водорода:

3) По закону эквивалентов находим эквивалентную массу металла:
Мэк =  = 32,6
= 32,6
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2859; Нарушение авторских прав?; Мы поможем в написании вашей работы!