
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пероксиды
|
|
|
|
От оксидов следует отличать пероксиды, например:
| H2O | – оксид водорода (вода) | H2O2 | – пероксид водорода |
| Na2O | – оксид натрия | Na2O2 | – пероксид натрия |
| BaO | – оксид бария | BaO2 | – пероксид бария |
В оксидах и в пероксидах число образуемых атомами кислорода химических связей одинаковое (две связи), и это означает, что электронная валентность, равная числу связей, у кислорода в пекроксидах равна двум. Но стехиометрическая валентность кислорода различная: в оксидах она равна II, а в пероксидах – I. Соответственно степень окисления кислорода в оксидах равна –2, а в пероксидах –1. Это различие объясняется тем, что в молекулах пероксидов имеется химическая связь между атомами кислорода. Отличие пероксидов от оксидов хорошо видно на структурных формулах
Вода H2O
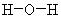
| Оксид натрия Na2O

| Оксид бария BaO

|
Пероксид водорода H2O2

|
Пероксид натрия Na2O2
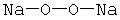
|
Пероксид бария BaO2

|
Число пероксидов невелико: это пероксид водорода (H2O2) и пероксиды щелочных и щелочноземельных металлов: K2O2, CaO2 и т.д. Другие элементы устойчивых пероксидов не образуют. Пероксиды, подобно оксидам, взаимодействуют с водой, но при этом образуется не только щёлочь, но и кислород:
2Na2O2 + 2Н2O = 4NaOН + O2; 2BaO2 + 2Н2O = 2Ba(OН)2 + O2
Пероксиды взаимодействуют с кислотными оксидами, при этом образуется соль и кислород. Например, пероксид натрия взаимодействует с углекислым газом по уравнению:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
На этой реакции основано применение пероксида натрия для регенерации кислорода в замкнутых помещениях. Пероксид водорода – сильный окислитель, на чём основано его применение в ракетных двигателях, для отбеливания тканей и в медицине (дезинфицирующее средство).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 7823; Нарушение авторских прав?; Мы поможем в написании вашей работы!