
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура солей
|
|
|
|
Состав и классификация солей
Соли
Солями называются соединения, состоящие из катионов металлов (или аммония) и анионов – кислотных остатков: KCl, Na2SO4, K3PO4, NH4Cl, (NH4)2SO4 и т.д.
Соли можно рассматривать как продукты взаимодействия кислот с основаниями, при этом могут получаться нормальные, кислые и оснóвные соли.
Нормальные соли (их называют также средними) образуются в том случае, когда количеств кислоты и основания достаточно для полного взаимодействия:
H2SO4 + 2NaOH = Na2SO4 + H2O
H3PO4 + 3KOH = K3PO4 + H2O
Кислые соли (или гидросоли) образуются при недостатке основания, когда катионов металла в составе основания недостаточно для замещения всех катионов водорода в молекуле кислоты:
H2SO4 + NaOH = NaHSO4 + H2O
H3PO4 + KOH = KH2PO4 + H2O
H3PO4 + 2KOH = K2HPO4 + 2H2O
В кислых солях в составе кислотных остатков содержится водород. Кислые соли возможны для многоосновных кислот и невозможны для одноосновных.
Оснóвные соли (или гидроксосоли) образуются при избытке основания, когда анионов кислотных остатков недостаточно для полного замещения всех гидроксогрупп в основании:
Al(OH)3 + HCl = Al(OH)2Cl + H2O
Al(OH)3 + 2HCl = AlOHCl2 + H2O
В оснóвных солях содержатся гидроксогруппы. Оснóвные соли возможны для металлов с валентностью II и выше и невозможны для одновалентных металлов.
Некоторые оснóвные соли самопроизвольно разлагаются с выделением воды; при этом образуются оксосоли, например:
Sb(OH)2Cl = SbOCl + H2O
Bi(OH)2NO3 = BiONO3 + H2O
Оксосоли обладают всеми свойствами оснóвных солей.
Таким образом, по составу и химическим свойствам, которые зависят от состава, соли подразделяются на четыре типа: нормальные, кислые, оснóвные и оксосоли. Соответствующая схема классификации солей приведена на рис. 4.
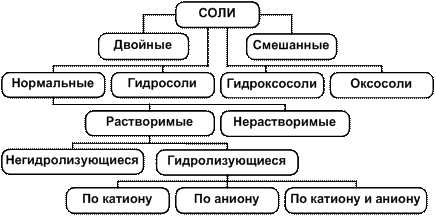
Рис. 4. Схема классификации солей
Существуют также двойные и смешанные соли. Двойные соли содержат два различных катиона и один анион, например: KCr(SO4)2, KAl(SO4)2, KNaCO3, (NH4)Fe(SO4)2. Смешанные соли, наоборот, содержат один катион и два разных аниона; примером смешанной соли является т.н. хлорная (белильная) известь – смешанная соль хлорида и гипохлорита кальция CaCl2·Ca(ClO)2, формулу которой записывают в виде СaOCl2.
Многие соли в твёрдом состоянии являются кристалогидратами, т.е. содержат в своём составе воду, например: CuSO4∙5H2O, FeSO4∙7H2O, BaCl2∙2H2O и т.д. Но выделять кристаллогидраты в отдельную группу нельзя, т.к. вода может быть в составе любой соли.
Существует также классификация солей по растворимости в воде и по типу гидролиза. Эти классификации рассматриваются при изучении растворов.
Названия солей связанны с названиями соответствующих кислот: соли хлороводородной кислоты называются хлоридами, серной – сульфатами, азотной – нитратами, азотистой – нитритами и т.д. Таким образом, если в названии кислот используются русские названия химических элементов, то в названиях солей – соответствующие латинские названия этих элементов. В справочнике приведены названия нормальных солей 38 наиболее распространённых кислот.
Названия кислых солей имеют приставку гидро- (один атом водорода) или дигидро- (два атома водорода) к названию аниона: K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия, NaHCO3 – гидрокарбонат натрия и т.д. Названия оснóвных солей имеют приставку гидроксо- или дигидроксо- к названию катиона металла: AlOH(NO3)2 – нитрат гидроксоаллюминия; Cr(OH)2Cl – хлорид дигроксохрома (III) и т.д. Названия оксосолей имеют приставку оксо - или диоксо- к названию катиона металла: BiOCl – хлорид оксовисмута (III), TiOBr2 – бромид оксотитана (IV), UO2(NO3)2 – нитрат диоксоурана (VI).
В названиях двойных солей катионы, а в названиях смешанных солей анионы записываются один за другим через дефис: KNaCO3 – карбонат натрия-калия, (NH4)Fe(SO4)2 – сульфат железа (III)-аммония, СaOCl2 – гипохлорит-хлорид кальция.
Названия кристаллогидратов начинаются с указания количества (греческими названиями чисел) связанной воды: CuSO4∙5H2O – пентагидрат сульфата меди (II), Nа2CO3∙10H2O – декагидрат карбоната натрия и т.д.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 5198; Нарушение авторских прав?; Мы поможем в написании вашей работы!