
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Направление химических реакций
В химической термодинамике теоретически решён вопрос о способности веществ к химическому взаимодействию или, как принято говорить, о возможности самопроизвольного протекания реакции в прямом направлении.
Большинство реакций сопровождается выделением тепла, т.е. уменьшением энтальпии, следовательно, при протекании таких реакций внутренняя энергия продуктов реакции уменьшается по сравнению с внутренней энергией исходных веществ. На основание этого Бертло (Фр.) и Томсон (Англ.) в середине 19-го столетия сформулировали следующий принцип: самопроизвольно в прямом направлении протекают реакции, сопровождающиеся выделением тепла (экзотермические реакции).
Механические предметы стремятся занять положение, отвечающее минимуму потенциальной энергии: камень падает вниз, вода стекает с гор и т.д. Бертло и Томсон отождествили химические системы с механическими, а внутреннюю энергию с потенциальной. Но химическая форма движения материи гораздо сложнее механической и вскоре это проявилось в открытии многих реакций, самопроизвольно протекающих с поглощением тепла, например:
С(графит) + Н2О(г) = СО(г) + Н2(г); DН° = 131,3 кДж/моль.
Отличие химических систем от механических заключается в том, что они образованы огромным числом мельчайших частиц – молекул, атомов, ионов. В таких системах существуют две движущие силы (два фактора) самопроизвольного процесса: один стремится уменьшить энергосодержание и выделить теплоту (энтальпийный фактор), а второй стремится привести систему в состояние с большим беспорядком (энтропийный фактор).
Состояние любой совокупности частиц, в том числе химического вещества или реагирующей системы, можно охарактеризовать двумя способами: 1) указать характеристики макросостояния вещества – давление, температуру, массу и т.п.; 2) указать характеристики микросостояния, т.е. мгновенные характеристики каждой частицы вещества – положение в пространстве, скорость и направление перемещения и т.д. Поскольку вещества состоят из огромного числа частиц, то одному макросостоянию отвечает огромное количество различных микросостояний, т.к. положение частиц, направление и скорость их перемещения непрерывно меняются. Число микросостояний, соответствующих данному макросостоянию, называется термодинамической вероятностью состояния вещества (w).
Энтропия вещества (S) связана с термодинамической вероятностью его состояния соотношением:
S = 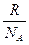 ·lnw,
·lnw,
которое позволяет перейти от огромных величин w к сравнительно небольшим значениям S и выразить энтропию в энергетических единицах измерения – Дж/(моль·К). Таким образом, энтропия – это логарифмическое выражение вероятности существования вещества.
Энтропия идеального кристалла при 0 К равно нулю (третий закон термодинамики), что вполне объяснимо: при абсолютном нуле прекращаются все виды движения атомов и молекул, одному макросостоянию соответствует одно микросостояние, т.е. w = 1, ln w = 0 и S = 0.
При нагревании энтропия возрастает, т.к. возрастает интенсивность движения частиц, растет число способов их расположения Резкое увеличение энтропии происходит при плавлении твёрдых веществ и испарении жидкостей (рис. 1).
Рисунка пока нет
Рис. 1. Изменение энтропии при нагревании вещества
Энтропия увеличивается при расширении газов, растворении твердых веществ. Таким образом, энтропия является количественной мерой беспорядка в веществе или системе.
Стандартной энтропией Sº называется энтропия вещества при 25 °С (298 К) и 101325 Па, при этом газы считаются идеальными, а растворенные вещества и ионы в растворах имеют концентрацию 1 М. Стандартная энтропия вещества – это справочная величина.
Для стандартных энтропий наблюдаются следующие закономерности.
1. Усложнение состава вещества приводит к возрастанию его стандартной энтропии, например:
| Вещество | SO2 | SO3 | WCl2 | WCl4 | WCl6 |
| So, Дж/(моль·К) |
2. Энтропия газообразного состояния вещества выше, чем жидкого, а жидкого выше, чем твердого; энтропия аморфного состояния больше, чем кристаллического, например:
| Вещество | Н2О(г) | Н2О(ж) | Н2О(к) | Al(OH)3(к) | Al(OH)3(ам) |
| So, Дж/(моль·К) | 188,7 | 70,1 | 39,3 |
3. Для аллотропных модификаций одного и того же вещества меньшее значение энтропии имеет модификация с более прочными химическими связями между атомами, например, энтропия алмаза равна 2,4 Дж/(моль·К), а графита 5,7 Дж/(моль·К).
По стандартным энтропиям можно сравнивать вещества по степени их беспорядка и находить энтропию химических реакций DSo аналогично тому, как определяется их энтальпия:
DSo = Sn·Soпрод – Sn·Soреаг
Пример 6. Вычислите стандартную энтропию химической реакции:
2С(графит) + 3Н2(г) = С2Н6(г)
Решение.
DSo = So(С2Н6) – [2·So(Cграфит) + 3So(Н2)]
DSo = 229,5 – (2·5,7 + 3·130,5)
DSo = –172,7 Дж/К
Для многих реакций знак энтропии определяется без проведения расчётов. Энтропия увеличивается, если среди реагентов нет, а среди продуктов реакции имеется газообразное вещество. Если газы являются и реагентами, и продуктами, то энтропия положительна тех реакций, в которых количество газообразных продуктов больше количества газообразных реагентов. Если количества газов в левой и правой части уравнения реакции одинаковы, то энтропия положительна тех реакций, в которых из простых газообразных веществ образуются соединения.
Пример 7. Не проводя расчетов, определите знак DSº химических реакций:
1) СаО(к) + СО2(г) = СаСО3(к)
2) (NH4)2Cr2O7(к) = Cr2O3(к) + N2(г) + 4Н2О(г)
3) N2(г) + O2(г) = 2NO(г)
Решение. В первой реакции энтропия уменьшается (DSº < 0), т.к. в числе реагентов имеется газообразное вещество, а среди продуктов реакции подобного вещества нет. Во второй реакции энтропия увеличивается (DSo > 0), поскольку газообразные вещества являются продуктами реакции. В третьей реакции энтропия, несмотря на одинаковое количество газов – реагентов и продуктов, также увеличивается (незначительно, но увеличивается), потому что из простых веществ образуется соединение.
По изменению энтропии можно предсказать направление таких процессов, в которых энтальпийный фактор отсутствует (изолированные системы) или он очень мал. Это расширение сжатого газа, смешивание газов, не взаимодействующих друг с другом, испарение жидкости и т.д. Энтальпии таких процессов, обусловленные изменением энергии межмолекулярного взаимодействия, невелики, и их можно не учитывать. В изолированных системах самопроизвольно протекают такие процессы, при которых энтропия возрастает.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1748; Нарушение авторских прав?; Мы поможем в написании вашей работы!