
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса
|
|
|
|
Одновременное действие энтальпийного и энтропийного факторов в химической термодинамике учитывается введением еще одного термодинамического параметра – энергии Гиббса (DG), который связан с DH и DS соотношением:
DG = DH – T·DS
Поскольку энергия Гиббса учитывает оба фактора, влияющие на направление процесса, то этот параметр является показателем способности вещества к химическому взаимодействию, мерой «химического сродства», критерием принципиальной осуществимости реакции, т.е. возможности ее самопроизвольного (без затраты энергии) протекания в прямом направлении:
Самопроизвольный процесс при постоянной температуре и давлении возможен только в том направлении, при котором происходит уменьшение энергии Гиббса, или: самопроизвольные реакции характеризуются отрицательным значением энергии Гиббса (DG < 0).
Формулировка критерия самопроизвольного процесса вытекает из второго закона термодинамики (теплота не может самопроизвольно переходить от холодного тела к более теплому), является распространением этого закона на химические реакции.
В общей химии рассчитываетсястандартная энергия Гиббса с использованием стандартных энтальпий образования веществ и стандартныхэнтропий по уравнению:
DGoT = DHo – T·DSо,
где DHo – энтальпия реакции при 298 К, а DSo – энтропия реакции при 298 К.
Получаемая величина DGoT относится к стандартному состоянию реагирующих веществ: температура 298 К, твердые вещества находятся в наиболее устойчивой аллотропной модификации, газы – при давлении 101325 Па, а растворенные вещества – при концентрации 1 М. Но по ходу реакции вещества выходят из стандартного состояния (изменяется температура вследствие выделения или поглощения тепла, изменяется концентрация и т.д.), поэтому пользоваться стандартной энергией Гиббса как критерием самопроизвольности реакции необходимо с некоторой осторожностью, а именно: самопроизвольная реакция при любых условиях возможна, если ее стандартная энергия Гиббса намного меньше нуля (DGoT < –50 кДж) и невозможна, если она намного больше нуля (DGoT > 50 кДж).
Рассмотрим несколько примеров.
1. Для реакции:
Zn(к) + 1/2О2(г) = ZnO(к); DGo298 = –320,7 кДж
Такое большое отрицательное значение энергии Гиббса при 25 °С свидетельствует о том, что при этой температуре цинк может окисляться не только при давлении кислорода 101325 Па, но и при меньшем давлении.
2) Для реакции:
N2(г) + 2Н2О(ж) = NH4+(p) + NO2-(р); DGo298 = 358 кДж,
поэтому данный способ фиксации азота неосуществим: под каким бы давлением не пропускался азот через воду, ионы NH4+ и NO2- в воде не появятся.
3. Для реакции:
3Н2(г) + N2(г) = 2NH3(г); DGo673 = 48 кДж.
Это означает, что синтез аммиака при 400 °С не осуществим, если каждый из реагентов находится при давлении 101325 Па. Но при высоких давлениях синтез аммиака при этой температуре возможен и его проводят в промышленности при высоком давлении, в 300–500 раз выше стандартного.
В некоторых случаях знак DGoT и, следовательно, направление реакции можно определить, не рассчитывая энергию Гиббса?
Из уравнения DGoT = DHo – T·DSº следует, что если DHo < 0 и DSo > 0, то в этом случае всегда DGoT < 0, т.е. экзотермическая реакция. протекающая с увеличение энтропии, возможна при любой температуре. К таким относится, например, реакция:
С(графит) + O2(г) = СО2(г); DН° = –393,5 кДж/моль; DSo = 3,0 Дж/К
При DHo > 0 и DSo < 0 энергия Гиббса при любых температурах положительна (DGoT > 0), следовательно, эндотермическая реакция, протекающая с уменьшением энтропии, невозможна ни при каких температурах. К таким относится, например, реакция окисления азота с образованием оксида четырёхвалентного азота:
N2(г) + 2О2(г) = 2NO2(г); DН° = 17,8 кДж/моль; DSo = –121,1 Дж/К.
В остальных случаях знак DGoT зависит от соотношения величин DHo и T·DSo, и реакция возможна только в том случае, если DGoT < 0.
Поскольку значение энтропийного фактора тем меньше, чем ниже температура, то при низких температурах им можно пренебречь, т.е. судить о возможности протекания реакции только по ее тепловому эффекту (принцип Бертло – Томсона). Для реакций при высоких температурах, наоборот, энтропийный фактор может быть таким значительным, что можно пренебречь энтальпийной составляющей и о направлении реакции судить только по изменению энтропии. Именно так поступают при исследовании реакций в плазмохимии, где температура процессов составляет несколько тысяч градусов.
Температуру, при которой изменяется направление протекания реакции можно не только определить графически, но и вычислить. При этой температуре DGoT = 0, следовательно:
DHo – T·DSo = 0; DHo = T·DSo ; 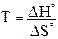
Пример 8. Вычислите энергию Гиббса при 500 °С для реакций разложения карбонатов кальция и магния и определите, какой из них разлагается при этой температуре.
Решение. 1) Записываем уравнения реакций и находим в справочной литературе термодинамические свойства веществ:
| Реакция | СаСО3 | == | СаО | + | СО2 | МgCO3 | = | MgO | + | CO2 | |
| DfН°, кДж/моль | –1206,9 | –635,5 | –393,5 | –1113,0 | –601,8 | –393,5 | |||||
| S°, Дж/(моль·К) | 92,9 | 39,7 | 213,7 | 65,7 | 26,9 |
2) Для первой реакции вычисляем энтальпию, энтропию и энергию Гиббса при 773 К:
DН° = (–393,5 –635,5) – (–1206,9) = 177,9 кДж
DS°= 213,7 + 39,7 - 92,6 = 160,8 Дж/К = 0,1608 кДж/К
DG°773 = 177,9 – 773·0,1608 = 53,6 кДж
3) Проводим такие же вычисления для второй реакции:
DН° = (–393,5 – 601,8) – (–1113,0) = 117,7 кДж
DS° = 213,7 + 26,9 - 65,7 = 174,8 Дж/К = 0,1748 кДж/К
DG°773 = 117,4 – 773·0,1748 = –17,7 кДж
Из расчетов следует, что СаСО3 не разлагается, а МgCO3 разлагаться при 500 °С.
Пример 9. При каких температурах кислород окисляет хлороводород по реакции:
4HСl(г) + О2 D 2Н2О(г) + 2Сl2,
а при каких хлор, наоборот, окисляет воду по обратной реакции?
Решение. 1) Находим в справочной литературе термодинамические свойства веществ:
| Вещество | HСl(г) | О2 | Н2О(г) | Сl2 |
| DfН°, кДж/моль | –91,8 | –241,8 | ||
| S°, Дж/(моль·К) | 186,8 | 205,0 | 188,7 | 222,9 |
2) Вычисляем энтальпию реакции при стандартных условиях:
DН° = (–241,8)·2 – (–91,8)·4 = –116,4 кДж
3) Рассчитываем энтропию:
DS° = 2·222,9 + 2·188,7 – 205,0 – 4·186,8 = –128,9 Дж/К = –0,1289 кДж/К
4) Вычисляем температуру, при которой прямое направление реакции изменяется на обратное:
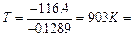 630 °С
630 °С
Из этого примера следует, что до 630 °С протекает прямая реакция кислород окисляет хлороводород), а при более высоких температурах протекает обратная реакция (хлор окисляет пары воды). Таким образом, этот пример показывает относительный характер понятий «окислитель» и «восстановитель».
Температура 630 °С относится к стандартному состоянию реагирующих веществ, т.е. к давлению 101325 Па, но при другом давлении температура также будет другой.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2228; Нарушение авторских прав?; Мы поможем в написании вашей работы!