
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Жилых помещений
|
|
|
|
Критерии для санитарной оценки воздуха
(число микроорганизмов в 1 м3 воздуха) по А.И.Шафиру
| Оценка воздуха | Летний режим | Зимний режим |
| Чистый | Менее 1500 | Менее 4500 |
| Грязный | Более 2500 | Более 7000 |
Работа 11. Выделение и количественный учет микроорганизмов почвы методом прямого счета С.Н. Виноградского
Оборудование: почвенные образцы, весы, разновесы, стерильные часовые стекла, ступки, резиновые перчатки, скальпели, пинцеты, колбы с 45 мл стерильной дистиллированной воды, стерильные пипетки на 0,1-0,2 мл, обезжиренные предметные стекла, 5-процентный раствор карболового эритрозина, 100-процентный этиловый спирт, микроскопы с иммерсионной системой, объектив-микрометр.
Ход работы
1. Небольшое количество почвы растирать в течение 10 минут в стерильной ступке пальцем в резиновой перчатке.
2. На стерильном часовом стекле отвесить 5 г почвы и перенести ее в колбу с 45 мл стерильной дистиллированной воды, получая разведение 1:10.
3. Встряхивать колбу 5 минут, отстоять 3-5 секунд и стерильной пипеткой перенести 0,01 мл взвеси на обезжиренное предметное стекло.
4. Распределить мазок по вычерченному заранее квадрату площадью 4 см2 стерильной иглой.
5. Мазок высушить, зафиксировать, прокрасить карболовым эритрозином в течение 30 минут.
6. Промыть, высушить препарат.
7. Микроскопировать с полной иммерсионной системой, производя подсчет микроорганизмов.
Подсчет ведут в трех-пяти полях зрения микроскопа (при более точных методиках - в 50-100).
8. Рассчитать количество микроорганизмов в 1 г почвы по формуле:
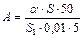 ,
,
где α – среднее количество микроорганизмов в поле зрения микроскопа, S – площадь мазка (400 мм2), S 1 – площадь поля зрения микроскопа (π r 2), 0,01 – капля суспензии для мазка (мл), 5 – навеска почвы (г).
9. Сделать вывод о микрофлоре почвы, опираясь на данные С.Н. Виноградского: бедные почвы – 200-500 млн. бактерий в 1 г почвы; средние – до 1 млрд.; богатые – до 2 млрд. и выше.
Работа 12. Анализ микрофлоры воды из различных источников.
Определение общего микробного числа
Оборудование: пробирки со стерильным МПА (СПА), стерильные чашки Петри, стерильные пипетки на 1 мл, пробирки с 9 мл стерильной воды, спиртовки, пробы воды из разных источников, карандаш по стеклу, шпатель.
Ход работы
1. Соблюдая стерильность, приготовить три разведения пробы: 1:10, 1:100, 1:1000.
2. Разлить МПА (СПА) в чашку Петри.
3. 0,1 мл воды третьего разведения стерильной пипеткой перенести в чашку Петри и разровнять шпателем по поверхности застывшей среды.
4. Через 5-7 дней подсчитать число колоний в чашке Петри и определить количество бактерий в 1 мл воды (умножая на разведение).
5. Данные оформить в таблицу:
| Источник воды | Кол-во микроорганизмов в 1 мл воды |
6. Определить сапробность зоны водоема, сравнить со следующими нормами:
- олигосапробная – 10 - 1000 бактерий в 1 мл;
- мезосапробная – до 100 000 бактерий в 1 мл;
- полисапробная – до 1 000 000 бактерий и более в 1 мл.
Работа 13. Измерение объектов
Измерять клетки микроорганизмов (в мкм) можно на фиксированных и живых препаратах с помощью шкалы окулярного микрометра — окулярной линейки. У кокков определяют диаметр клеток, у бактерий другой формы — длину и ширину.
Оборудование: фиксированные или живые препараты (дрожжи), предметные и покровные стекла, микробиологические петли, окулярная линейка, микроскоп.
Ход работы
1. Вставляют окулярную линейку шкалой вверх на диафрагму окуляра, предварительно вывинтив линзу окуляра.
2. Затем ставят препарат и определяют, скольким делениям линейки соответствует длина и ширина клетки. Измеряют не менее 10—20 клеток.
3. Чтобы рассчитать истинные размеры клеток, определяют цену деления окулярной линейки с помощью объектного микрометра. Последний представляет собой металлическую пластинку в форме предметного стекла с отверстием в центре; в отверстие помещено стекло с линейкой (шкала из 100 делений). Общая длина шкалы объектного микрометра — 1 мм, величина одного деления — 10 мкм (0,01 мм).
4. Для определения цены деления окулярной линейки объектный микрометр помещают вместо препарата на столик микроскопа и фокусируют изображение линейки при малом увеличении. Затем линейку перемешают в центр поля и меняют объектив на тот, при котором измеряли клетки. Передвигая столик микроскопа и поворачивая окуляр, устанавливают объектный и окулярный микрометры так, чтобы их шкалы были параллельны и одна перекрывала другую. Определение цены деления окулярного микрометра проводят по принципу нониуса, т. е. совмещают одну из черт шкалы окулярного микрометра с чертой объектного микрометра и находят следующее совмещение. Допустим, в двух делениях объектного микрометра (20 мкм) умещается пять делений окулярного микрометра, тогда одно деление окулярного микрометра при данном увеличении равняется 4 мкм (20: 5). Зная, скольким делениям окулярной линейки соответствует длина и ширина изучаемых клеток, умножают цену деления окулярного микрометра на эти числа. Полученные значения цены делений окулярной линейки справедливы только для данной системы окуляр — объектив.
Работа 14. Микрофлора слизистой оболочки полости рта и зубного налета
В полости рта обнаруживается более 100 видов микроорганизмов. Среди них дрожжи, стрептококки, стафилококки, крупные палочки, спирохеты, вибрионы и т.д.
Оборудование: спички, спиртовка, предметные стекла, краситель (фуксин или метиленовый синий), микроскоп с иммерсионной системой.
Ход работы
1. Спичкой взять кусочек зубного налета, перенести в каплю воды на предметное стекло, сделать мазок.
2. Мазок зафиксировать и покрасить.
3. Микроскопировать с иммерсионной системой, отмечая разнообразие форм микроорганизмов (рис 5).
4. Зарисовать.

Рис. 5. Микрофлора зубного налета
Работа 15. Микрофлора кожных покровов
Оборудование: пробирки со стерильным МПА (СПА), чашки Петри, микроскоп с иммерсионной системой, краситель.
Ход работы
1. Разлить агар в две чашки Петри.
2. Прикоснуться к застывшей агаровой пластинке одной чашки грязными руками, другой – чистыми.
3. После инкубации в течение 3-5 дней при t = 25-30ºС подсчитать колонии, сделать выводы.
4. Микроскопировать окрашенные мазки разных колоний, выполнить соответствующие рисунки.
Тема 5. ПОЛУЧЕНИЕ ЧИСТЫХ КУЛЬТУР.
ИЗУЧЕНИЕ ОСОБЕННОСТЕЙ МИКРООРГАНИЗМОВ С ЦЕЛЬЮ ИХ ИДЕНТИФИКАЦИИ (4 ч)
Идентификацию микроорганизмов проводят путем изучения морфологических, культуральных и физиологических свойств.
Морфологические свойства исследуются при микроскопировании, культуральные устанавливаются по особенностям роста на питательных средах (рис. 6), физиологические изучаются при выращивании на дифференциально-диагностических средах.
Работа 16. Получение чистой культуры бактерий
Оборудование: чашки Петри с колониями, полученными при анализе воздуха, микробиологические иглы, спиртовка, пробирки со стерильными питательными средами: МПА (СПА) прямой, МПА (СПА) косой, МПБ, МПЖ, молоко, картофельные среды.
Ход работы
Описание выбранной колонии
Описание проводят по схеме:
1. Размер колонии: точечные (Д меньше 1 мм), средние (Д – 2-4 мм), крупные (Д – 4-6 мм и более).
2. Форма (округлая, неправильная, амебовидная, ризоидная, мицелиальная).
3. Оптические свойства (прозрачная, матовая, флюоресцирующая, полупрозрачная, непрозрачная, блестящая).
4. Цвет и выделение пигмента в среду.
5. Поверхность (гладкая, шероховатая, складчатая, бугристая).
6. Профиль (плоский, выпуклый, кратерообразный, конусовидный).
7. Край (ровный, волнистый, лопастной, ризоидный).
8. Структура (однородная, мелко- и крупнозернистая, струйчатая, волнистая).
9. Консистенция (маслянистая, тестообразная, вязкая, пленчатая).
Составив описание колонии, делают пересев в чистую культуру на твердые и жидкие среды.

Рис. 6. Характеристика колоний:
форма: а – округлая, б – неправильная, в – амебовидная, г – ризоидная, д – мицелиальная; профиль: а – плоский, б – выпуклый, в – кратерообразный, г – конусовидный; край: а – ровный, б – волнистый, в – лопастной, г – бахромчатый; структура: а – однородная, б – мелкозернистая, в – крупнозернистая, г – струйчатая, д – волнистая.
Пересев микроорганизма в чистую культуру
А. На прямой МПА (СПА) (микробиологической иглой):
1. Берут микробиологическую иглу в правую руку (рис. 7), прокаливают ее на пламени спиртовки, дают остыть, приоткрывают чашку Петри, дотрагиваются до агара (агар не должен плавиться), захватывают часть выбранной колонии.
 |
Рис. 7. Посев культуры микроорганизмов в пробирки со средой:
а, е – стерилизация петли; б – стерилизация краев пробирки;
в, г – взятие и посев материала; д – закрытие пробирок пробками
2. Тремя пальцами левой руки берут пробирку с агаром, мизинцем и безымянным пальцем правой руки вынимают из нее ватную пробку, обжигают края.
3. Вводят иглу в пробирку, вертикально делают укол почти до дна, вынимают иглу.
4. Обжигают горло пробирки и пробку, закрывают пробирку, этикетируют.
Б. На косой МПА (СПА) (микробиологической петлей):
1. Разогревают агар и размещают на подставке для косого наклона среды. Среда должна иметь наибольшую площадь и не должна касаться пробки.
2. Соблюдая те же правила, что и при посеве уколом, совершают посев штрихом по поверхности агара. Этикетируют.
Посев на дифференциально-диагностические среды
Из выращенной чистой культуры, соблюдая правила стерильности, производят посев на: 1 – МПБ, 2 – МПЖ, 3 – молоко, 4 – картофельную среду. В МПЖ – уколом иглой, в остальные – микробиологической петлей или шпателем Дригальского (рис. 8).
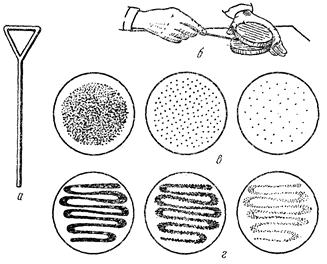
Рис. 8. Посев микроорганизмов на поверхность плотной среды в чашках Петри:
а – шпатель Дригальского; б – положение чашки и руки при посеве шпателем; в – рост микроорганизмов после рассева шпателем; г - рост микроорганизмов после рассева петлей
Работа 17. Окраска бактерий по Граму
Оборудование: пробирки с чистой культурой, обезжиренные предметные стекла, петли, спиртовка, кристаллизатор с подставкой, промывалка с водой, однопроцентный раствор кристаллвиолетта, раствор Люголя, 95-процентный этанол (ацетон), 0,1-процентный раствор фуксина, микроскоп с иммерсионной системой.
Ход работы
1. Тонкий мазок высушить, зафиксировать, нанести раствор кристаллвиолетта на 1-2 минуты.
2. Залить раствором Люголя на 1-2 минуты.
3. Промыть водой и этанолом (ацетоном) в течение 60 сек или в течение 10 сек.
4. Промыть водой. Докрасить фуксином 2 мин.
5. Высушить. Микроскопировать.
Грамположительные бактерии окрашиваются в сиренево-фиолетовый цвет, грамотрицательные – в малиновый.
Работа 18. Обнаружение капсул на негативном прижизненном
препарате
Оборудование: чистая культура, предметные стекла, карболовый фуксин Циля, черная тушь, спиртовка, петли, микроскоп.
Ход работы
1. Каплю культуры на предметном стекле окрасить фуксином в течение 2-3 минут.
2.  Прибавить черную тушь, накрыть покровным стеклом.
Прибавить черную тушь, накрыть покровным стеклом.
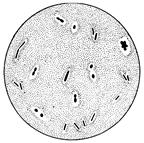
3. Микроскопировать (рис. 9). Зарисовать в альбом.
Рис. 9. Капсулы у бактерий
Работа 19. Окраска спор
Оборудование: предметные стекла, петли, исследуемая культура, спиртовка, фильтровальная бумага, кристаллизатор с подставкой, промывалка с водой, однопроцентный раствор серной кислоты, пятипроцентный раствор хромовой кислоты, карболовый фуксин Циля, раствор метиленового синего (1:40), микроскоп с иммерсией.
Ход работы
1. Приготовить мазок, высушить, зафиксировать. Протравить пятипроцентным раствором хромовой кислоты в течение 5 минут.
2. Промыть водой, залить карболовым фуксином Циля. Окрашивать в течение 5 минут, нагревая над пламенем до появления паров и добавляя краситель.
3. Промыть, обесцвечивать в течение 2 минут серной кислотой.
4. Промыть, докрасить метиленовым синим в течение 10-15 минут.
5. Промыть, высушить, микроскопировать. Клетки должны быть синими, а споры - красными.
Работа 20. Обнаружение запасных включений
Оборудование: предметные и покровные стекла, петли, спиртовка, вода, пинцет, фильтровальная бумага, кристаллизатор с подставкой, микроскоп с иммерсией, метиленовый синий (1:40), раствор Люголя, судан III, 40-процентный формалин, исследуемая культура.
Ход работы
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 1523; Нарушение авторских прав?; Мы поможем в написании вашей работы!