
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика и термодинамика в описании процесса роста при молекулярно-пучковой эпитаксии
|
|
|
|
На первом этапе исследований (конец 70-х-начало 80-х годов прошлого века) преобладало мнение, что МПЭ является сугубо неравновесным процессом, т.к. вещества, поступающие на подложку и продукты реакции, в общем случае, имеют разные температуры. Поэтому термодинамические представления считались неприменимыми, а информацию о процессах роста предполагалось получать только путем исследования кинетики конкретных реакций на поверхности. На основе экспериментов с модулированными пучками были развиты представления, согласно которым основную роль при МПЭ соединений АIIВVI (АIIIBV) играют элементарные процессы адсорбции, миграции, встраивания и десорбции атомов и молекул, а также разложение кристалла (рис. 6) [10]. Исследование этих процессов, протекающих на поверхности растущего слоя имеют не только фундаментальное значение, но также и огромную практическую значимость, связанную с дополнительными возможностями in situ контроля процесса роста эпитаксиальных слоев и гетероструктур. Сегодня интенсивно ведутся экспериментальные исследования поверхности с использованием широкого спектра различных методик, таких как ДБЭ, встроенная СТМ, лазерная интерферометрия и др.
Среди теоретических подходов, применяемых для описания и моделирования эпитаксиального роста соединений AIIIBV и АIIВVI следует
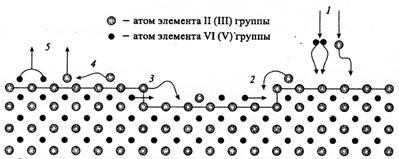
Рис. 6. Схематическое изображение основных процессов на подложке:
1 — адсорбция; 2 — встраивание; 3 — разложение; 4 — миграция; 5 — десорбция
прежде всего выделить метод Монте-Карло. Этот метод позволяет воспроизвести экспериментальные данные, но требует «а priori» определения большого числа параметров, которые могут быть лишь приблизительно оценены из первых принципов. В такой ситуации чрезвычайно актуальными являются упрощенные кинетические модели, содержащие минимальное число параметров. В основе большинства моделей заложено предположение, что все процессы протекают в адсорбционном слое, играющем роль «буфера» между кристаллом и вакуумом. Адсорбционный слой при этом, как правило, рассматривается как двойной, т.е. содержащий анионную и катионную плоскости. Рассмотрим несколько подробнее процессы, лежащие в основе кинетических моделей.
При анализе адсорбции необходимо учитывать особенности, присущие элементам II (III) и IV (V) групп. Для описания процесса адсорбции вводят понятие коэффициента прилипания или адсорбции. Для металлических элементов III группы величина этого коэффициента близка к единице, и не зависит от типа атомов покрывающих поверхность. Другими словами, атомы III группы и некоторые атомы второй группы (Ве, Мg) могут адсорбироваться на поверхность, уже покрытую слоем атомов III (II) группы. В результате это может приводить к образованию на поверхности роста включений металлической фазы и срыву двумерного послойного роста. В случае адсорбции летучих элементов картина оказывается намного сложнее.
Во-первых, коэффициент адсорбции зависит от степени покрытия ростовой поверхности элементами V (VI) группы, причем величина его близка к нулю для поверхности стабилизированной атомами элемента V (VI) группы.
А во-вторых, коэффициент адсорбции зависит от химического состава пара в падающем потоке. Величина коэффициента адсорбции, который по определению есть доля молекул падающего потока, хемисорбировавшихся на ростовой поверхности, зависит также от количества молекул, отраженных от поверхности роста. При этом в потоке молекул от подложки можно выделить две составляющих: молекулы, полностью идентичные падающим — отраженные от поверхности, и молекулы, которые термически десорбируются с поверхности. Атомы V (VI) группы имеют очень сильную зависимость коэффициента адсорбция от температуры роста. При описании миграции атомов и молекул на ростовой поверхности необходимо также учитывать зависимость подвижности атомов и молекул от температуры роста и количество атомов, составляющих молекулы.
Встраивание атомов в кристаллическую решетку и разложение кристалла, т.е. переход атомов из кристаллической решетки эпитаксиальной пленки в адсорбированный слой, — два основных процесса, происходящих между слоем адсорбированных атомов, которые мигрируют по поверхности, и растущим кристаллом. При анализе встраивания атомов необходимо учитывать, что может реализовываться два принципиально различных механизма роста: двумерный и трехмерный рост. В свою очередь, при описании двумерного роста необходимо разделять рост через образование двухмерных островков и через постепенное заполнение террас. Встраивание атомов в последнем случае происходит в углы террас, уступы и изломы. Встраивание атомов при образовании двумерных островков нового слоя имеет нуклеационную природу и характеризуется некоторой энергией активации. Реализация того или иного режима сильно зависит от условий роста и, в первую очередь, температуры подложки. Для описания процесса встраивания и разложения также вводят понятия коэффициентов встраивания и разложения.
Таким образом, при анализе кинетики необходимо решать систему двух нестационарных уравнении, которые отражают изменение поверхностной концентрации атомов элементов II (III) и VI (V) групп и содержат достаточно большое количество различных коэффициентов. В результате, даже при анализе закономерностей МПЭ бинарных полупроводников реальная картина оказывается чрезвычайно сложной.
Поэтому были предприняты попытки разработки целостного описания МПЭ в рамках термодинамической модели. Тот факт, что процесс МПЭ осуществляется в неравновесных условиях, формально не дает оснований утверждать, что термодинамический подход, основывающийся на применении уравнений действующих масс в совокупности с уравнениями сохранения массы взаимодействующих элементов, не может описать состояния системы. Такой подход широко и с успехом применяется для описания многих химических реакций, идущих в сугубо неравновесных условиях. В случае сублимации бинарных соединений (также сугубо неравновесного процесса) адекватность термодинамического подхода была подтверждена многочисленными экспериментальными данными задолго до возникновении МПЭ [11]. Примет некие термодинамического описания к процессам роста методом МПЭ стимулирует также и возможность использования большого теоретического и экспериментального материала, накопленного в жидкофазной и газофазной эпитаксиях.
В рамках термодинамического описания МПЭ рассматривается как квазиравновесный процесс, где равновесие между газовой и твердой фазой устанавливается на поверхности растущего слоя. За равновесные параметры системы принимается температура подложки и эффективные давления, соответствующие потокам молекул и атомов взаимодействующих элементов от поверхности роста [12].
Для расчета составов равновесных фаз необходимо прежде всего определить число химических элементов — Э, присутствующих в рассматриваемой системе, и число компонентов — К, образуемых этими атомами. Тогда, число независимых химических реакций
r = К — Э. (3)
Независимой называется такая реакция, которая не может быть получена линейной комбинацией других. Для независимых реакций записывают уравнения закона действующих масс, включающие равновесные парциальные давления компонентов, находящихся в газовой фазе, и активности компонентов конденсированной фазы. Входящие в уравнения константы равновесия определяют по справочным термодинамическим данным.
Для расчета всех неизвестных давлений необходимо дополнить систему уравнений равновесия уравнениями материального баланса. Уравнения закона действующих масс отражают влияние температуры на равновесное состояние системы, а уравнения материального баланса — влияние входных давлений реагентов.
При составлении уравнений материального баланса вводят понятие гипотетического давления элемента в газовой фазе. Равновесное гипотетическое давление  связано с искомыми равновесными парциальными давлениями компонентов
связано с искомыми равновесными парциальными давлениями компонентов  уравнением
уравнением
 , (4)
, (4)
где kг- — число компонентов газовой фазы; vij —- число атомов i -го элемента в компоненте j.
Рассмотрим реакцию между основными компонентами при МПЭ
классического полупроводника — GaAs. Согласно (3), число независимых реакций, описывающих МПЭ GaAs, разно r=4-2=2, принимая во внимание участие в реакции димеров двухатомных и тетрамеров четырехатомных молекул Аs:
GaAs(s) = Ga(g) + 1/2As2(g), (5)
As2(g) = 1/As4(g). (6)
Согласно уравнению сохранения масс, для давлений молекулярных пучков Аs и Gа, идущих на рост, имеем
 , (7)
, (7)
где  и
и  давление в падающих потоках атомов мышьяка и галлия на поверхность, соответственно.
давление в падающих потоках атомов мышьяка и галлия на поверхность, соответственно.
Решение системы вышеупомянутых уравнений дает значений равновесных парциальных давлений  ,
,  и
и  .
.
На рис. 7и 8 показаны рассчитанные равновесные парциальные давления над бинарными полупроводниками InAs, GaAs, AlAs, InSb, GaSb и AlSb как функция соотношения давлений падающих потоков элементов III и V групп и температуры подложки соответственно. При этом важно отметить, что на рис. 7 представлены результаты расчетов при различных температурах для разных полупроводников (наиболее типичных для МПЭ). Давление падающего потока элементов III группы (Аl, Gа и In) принималось равным  атм, а соотношение давлений потоков
атм, а соотношение давлений потоков  — равным 2.
— равным 2.
Как видно из рис. 7, существенные изменения на графиках происходят при соотношении  = 1 для всех бинарных соединений АIIIВV. Другая важная особенность, очевидная из рис. 7 состоит в том, что при типичных режимах эпитаксии, когда
= 1 для всех бинарных соединений АIIIВV. Другая важная особенность, очевидная из рис. 7 состоит в том, что при типичных режимах эпитаксии, когда  >1, над поверхностью почти всегда преобладает пар, состоящий из двухатомных молекул элементов V группы, что полностью совпадает с экспериментальными данными [13, 14]. Давление пара четырехатомных элементов V группы становится соизмеримым и даже превосходит давление пара двухатомных молекул, в основном, при больших соотношениях давлений
>1, над поверхностью почти всегда преобладает пар, состоящий из двухатомных молекул элементов V группы, что полностью совпадает с экспериментальными данными [13, 14]. Давление пара четырехатомных элементов V группы становится соизмеримым и даже превосходит давление пара двухатомных молекул, в основном, при больших соотношениях давлений  и достаточно низких температурах (см. рис. 8), как, например, в случае InAs и InSb.
и достаточно низких температурах (см. рис. 8), как, например, в случае InAs и InSb.
Из рис. 8 видно, что с увеличением температуры существенно возрастает равновесное давление пара элементов III группы. При некоторой температуре, когда давление пара III группы сравнивается с давлением пара элементов V группы, начинается эффективное разложение кристалла, а эта температура хорошо согласуется с предельной температурой эпитаксии.
Скорость роста соединений А3В5 при условии упомянутых выше предположений может быть просто записана в виде уравнения Герца-Кнудсена:
 , (8)
, (8)
где III — коэффициент встраивания атомов III группы, т — масса молекулы, k — постоянная Больцмана, Vс — объем молекулы растущего кристалла, Т — температура (К). При этом предполагается, что уравнения Герца-Кнудсена выполняются при температуре подложки. Поскольку III= 1, а зависимостью Т-1/2 в типичном температурном диапазоне эпитаксии можно пренебречь, выражение (8) можно записать в виде
 , (9)
, (9)
где k * - константа, не зависящая от температуры.

Рис 7. Зависимости равновесных давлений от соотношения давлений падавших потоков  для (
для ( атм): a) InAs, Тп = 500С; б) InSb, Тп = 450С; в) GaAs, Тп = 600С; г) GaSb, Тп = 500С; д) AlAs, Тп = 600С; е) AlSb, Тп = 600С.
атм): a) InAs, Тп = 500С; б) InSb, Тп = 450С; в) GaAs, Тп = 600С; г) GaSb, Тп = 500С; д) AlAs, Тп = 600С; е) AlSb, Тп = 600С.

Рис. 8. Зависимости равновесных давлений от температуры подложки
( =2; для
=2; для  атм) для: а) InAs; б) InSb; в) GaAs; г) GaSb;; д) AlAs; е) AlSb.
атм) для: а) InAs; б) InSb; в) GaAs; г) GaSb;; д) AlAs; е) AlSb.
Таким образом, зависимость скорости роста от технологических параметров будет находиться из расчета величин 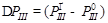 . Зависимости D Р III представлены для двух полупроводников — InAs и InSb, от давления падающего потока и соотношения давлений падающих потоков
. Зависимости D Р III представлены для двух полупроводников — InAs и InSb, от давления падающего потока и соотношения давлений падающих потоков  на рис. 9 и 10, соответственно.
на рис. 9 и 10, соответственно.
Линейная зависимость D Р III на рис. 9 от давления падающего потока In, сохраняется до тех пор, пока равновесное давление In

Рис. 9. Зависимость разности давления падающего потока и равновесного давления In 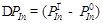 от соотношения падающих потоков
от соотношения падающих потоков 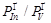 для двух полупроводников: а) InAs; б) InSb.
для двух полупроводников: а) InAs; б) InSb.

Рис. 10.Зависимость разности давления падающего потока и равновесного давления In 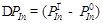 от давления падающего потока In для двух полупроводников: а) InAs; б) InSb.
от давления падающего потока In для двух полупроводников: а) InAs; б) InSb.
пренебрежимо мало в сравнении с давлением падающего потока (см. рис. 9 и 10 ). По мере уменьшения  эти давления становятся соизмеримы, и при
эти давления становятся соизмеримы, и при  зависимость отклоняется от линейной, и величина D Р резко уменьшается. Таким образом, при типичных режимах эпитаксии скорость роста линейно зависит от входного потока элемента III группы. Поэтому при соотношении
зависимость отклоняется от линейной, и величина D Р резко уменьшается. Таким образом, при типичных режимах эпитаксии скорость роста линейно зависит от входного потока элемента III группы. Поэтому при соотношении  > 1 величина D Р In на рис. 9постоянна и не зависят от давления падающего потока элементов V группы. При соотношении потоков
> 1 величина D Р In на рис. 9постоянна и не зависят от давления падающего потока элементов V группы. При соотношении потоков  < 1величина DP линейно уменьшается, т.к. скорость роста лимитируется скоростью доставки атомов Sb.
< 1величина DP линейно уменьшается, т.к. скорость роста лимитируется скоростью доставки атомов Sb.
Аналогичные зависимости DPIII от входных потоков реагентов могут быть получены для всех полупроводников АIIIВV и АIIВVI, а твердых растворов на их основе.
При некотором фиксированном давлении  сувеличением температуры подложки, растет равновесное давление (см. рис. 8), и при некоторой температуре величина D Р IIIстанет равной 0, и, соответственно, станет равна 0 и скорость роста. Зависимость скорости роста от температуры для различных полупроводников представлена на рис. 11. Скорости роста для разных полупроводников приведены
сувеличением температуры подложки, растет равновесное давление (см. рис. 8), и при некоторой температуре величина D Р IIIстанет равной 0, и, соответственно, станет равна 0 и скорость роста. Зависимость скорости роста от температуры для различных полупроводников представлена на рис. 11. Скорости роста для разных полупроводников приведены

Рис. 11. Зависимость относительной скорости роста от температуры подложки для разных полупроводников: 1 — InSb; 2 — InAs; 3 — GaAs; 4 — Gasb; 5 — AlSb; 6 — AlAs.
к единице, при этом значение температур, до которых скорость роста не изменяется, прямо коррелирует с величиной константы равновесия. Максимальная величина константы равновесия при данной температуре соответствует АlAs, минимальная — InSb. Соответственно, и температура начала резкого снижения скорости роста уменьшается от AlAs к InSb. Важно отметить, что эта температура зависит от входного потока элемента III группы и соотношения; давлений  увеличением потока III группы и соотношения
увеличением потока III группы и соотношения  эта температура увеличивается.
эта температура увеличивается.
Таким образом, в основе термодинамической модели МПЭ лежат следующие положения.
1. МПЭ рассматривается как квазиравновесный процесс, где равновесие между газовой к твердой фазой (или между газовой, жидкой и твердой фазами в случае образования сегрегационного слоя на поверхности) устанавливается на поверхности растущего слоя.
2. Основные термодинамические параметры:
• за температуру системы принимают температуру подложки;
• парциальные давления компонентов в отраженных потоках принимаются за равновесные;
• поток атомов от поверхности подложки рассматривается состоящим из двух частей: атомы входного потока, термаолизованные на поверхности и отраженные от подложки (избыточное давление на подложку), и потока атомов, обусловленного термической диссоциацией конденсирующегося вещества.
3. Скорость осаждения эпитаксиального слоя лимитируется скоростью поступления на подложку компонентов, имеющих наименьшее давление паров при температуре подложки (атомов III группы при МПЭ соединений АIIIВV). В этом случае избыточный по сравнению с необходимым для связывания атомов элементов III группы поток Элементов V группы переиспаряется и лишь определяет точку на фазовой диаграмме внутри области гомогенности и, соответственно, тип и концентрацию точечных дефектов.
Термодинамический подход успешно применяется при анализе закономерностей роста не только бинарных полупроводников, но и более сложных соединений — твердых растворов. С использованием термодинамического анализа оказалось возможным объяснить влияние упругих напряжений при выращивании сильно рассогласованных по периоду кристаллической решетки полупроводников [15, 16]. В частности, было показано, что возникающие вследствие дилатационного несоответствия напряжения приводят к переиспарению летучего компонента, поэтому начальные стадии эпитаксии в такого рода гетеропарах должны проводится при пониженной температуре роста. Более того, термодинамический подход успешно применялся и к анализу особенностей формирования структур с пониженной размерностью, в частности гетерограниц. В работе [17| на основании термодинамической модели нам удалось определить максимальную температуру формирования интерфейса типа InSb в структурах, не имеющих общих атомов при переходе через гетерограницу. Наконец, термодинамическая модель была успешно применена нами для описания процессов сегрегации примесей и базовых элементов на поверхности роста [18, 19, 20]. В то же время, как показали исследования, термодинамический подход ограниченно применим к многокомпонентным твердым растворам, содержащим несколько элементов V (VI) группы. В случае такого рода твердых растворов имеет место сильная конкуренция между атомами при встраивании в кристаллическую решетку, и решающую роль играют кинетические коэффициенты, т.е. необходимо использовать комбинацию термодинамического подхода с кинетическим, описанным выше.
Необходимо признать, что на сегодняшний день нет единого подхода к описанию МПЭ. При этом термодинамический подход, который представляется наиболее обоснованным в теоретическом плане, имеет ограниченное применение, поскольку связан с минимальным количеством экспериментальных параметров и, как следствие, обеспечивает -минимум информации о поверхностных процессах, что не позволяет полностью описать все экспериментальные данные. В то же время, несмотря на очевидную значимость кинетических моделей для повышения уровня понимания процессов роста при МПЭ на микроуровне, они зачастую терпят неудачу при попытках получения количественных зависимостей.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 840; Нарушение авторских прав?; Мы поможем в написании вашей работы!