
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Параметры смесей и химические реакции
|
|
|
|
Основные понятия кинетики реакций горения
Теоретические основы топочных процессов
Вопросы для самопроверки
1. Что такое теоретическое количество воздуха, необходимое для сжигания одного килограмма топлива? Как рассчитывается это количество воздуха? Чем отличается действительный расход воздуха от теоретического?
2. Как определяется объем сухих домовых газов? Каков порядок расчета объема водяных паров?
3. Что понимается под полным и неполным горением топлива?
4. Изложите порядок определения теоретического объема продуктов сгорания. Каково отличие действительного объема продуктов сгорания от теоретического?
5. Как составляются стехиометрические уравнения сгорания компонентов топлива?
6. Каков порядок расчета энтальпии продуктов сгорания? Изобразите диаграмму энтальпия - температура для продуктов сжигания при разных коэффициентах избытка воздуха.
7. Поясните физический смысл коэффициента избытка воздуха; как он определяется практически?
8. Уравнение теплового баланса процесса горения; поясните его составляющие.
9. Энтальпия дымовых газов, энтальпия воздуха, подаваемого для горения: физический смысл, единицы измерения и способы определения.
10. Поясните составляющие потерь процесса горения.
11. Дайте определение температуры вспышки, температуры воспламенения, температуры горения, теоретической и адиабатической температуры горения, расчет последних.
12. Напишите уравнения полного и неполного горения, поясните их составляющие.
В процессе работы с данным разделом Вма предстоит:
- изучить четыре темы;
- выполнить одну лабораторную работу (№ 6);
- выполнить блок практических занятий (задачи 8…14);
|
|
|
- ответить на вопросы для самопроверки;
- ответить на вопросы тренировочного теста № 3.
Газообразное топливо, пары жидкого топлива, воздух, продукты сгорания топлива состоят из различных химических компонентов, образующих газовую смесь. Состояние однокомпонентного газа определяется двумя термодинамическими параметрами: давлением и температурой, многокомпонентного – химическим составом, давлением и температурой. В процессе горения одни вещества исчезают и возникают другие. Термодинамика реагирующих в процессе горения веществ учитывает взаимные превращения веществ, энергии, теплоты и работы.
Состав сложной многокомпонентной смеси определяется концентрацией компонентов. Концентрацию i –го вещества в смеси определяют как число молекул Ni в единице объема V. В этом случае говорят о молекулярной концентрации
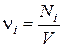 . (42)
. (42)
Молярная концентрация определяет число молей ni в единице объема
 . (43)
. (43)
Плотность i –го вещества
 , (44)
, (44)
где mi – масса молекулы i – го вещества,
 , (45)
, (45)
где Mi –молекулярная масса i -го вещества; NA = 6,02*1023 моль-1 – число Авагадро. Число молекул i -го вещества можно определить из выражения Ni = NAni.
Используя вышеприведенные выражения, легко установить связь между концентрациями
 . (46)
. (46)
Используют также относительные концентрации:
- относительная молярная концентрация определяется отношением
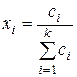 , (47)
, (47)
где  – число молей в смеси всех веществ, занимающих объем V, отнесенное к этому объему, т. е.
– число молей в смеси всех веществ, занимающих объем V, отнесенное к этому объему, т. е.  = С, тогда
= С, тогда  = 1;
= 1;
- относительная массовая концентрация
 (
( =
=  ;
;  =1). (48)
=1). (48)
Молекулярная масса смеси
 . (49)
. (49)
Отсюда
 и
и  . (50)
. (50)
Приведенные соотношения справедливы как для газов, так для твердых и жидких однородных смесей, в которых компоненты распределены равномерно по всему объему.
В теории горения принимается, что все компоненты газовой смеси являются идеальными газами, т. е. в них отсутствует взаимное притяжение между молекулами, а объем молекул пренебрежимо мал по сравнению с объемом, занимаемым газом. Уравнение состояния i- го газа устанавливает связь между его парциальным давлением рi, концентрацией  , температурой Т:
, температурой Т:
|
|
|
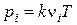 , (51)
, (51)
где k =1,38·10-23Дж/К – постоянная Больцмана. Известно, что k=R/NA, ранее было показано, что  , тогда
, тогда
 , (52)
, (52)
где R =8,31 Дж/(моль·К) – универсальная газовая постоянная.
Закон Дальтона, справедливый для идеальных газов, имеет вид
 , (53)
, (53)
т. е. давление смеси газов равно сумме парциальных давлений его компонентов.
Используя закон Авогадро (при одинаковых давлении и температуре одинаковые количества вещества различных идеальных газов занимают один и тот же объем), можно определить относительную молярную концентрацию i -го вещества из выражения
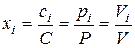 , (54)
, (54)
где Vi – парциальный объем i -го вещества.
Уравнение химических реакций в общем виде можно описать следующим выражением:
 (i =1,2…, k), (55)
(i =1,2…, k), (55)
где i - номер реагирующего вещества;  – стехиометрический коэффициент i -го реагента в прямой реакции (т. е. реакции, идущей слева направо);
– стехиометрический коэффициент i -го реагента в прямой реакции (т. е. реакции, идущей слева направо);  – то же для обратной реакции; Аi, Вi – химические символы i -х реагентов. Стехиометрические коэффициенты – это коэффициенты, определяющие количественные соотношения между реагирующими веществами.
– то же для обратной реакции; Аi, Вi – химические символы i -х реагентов. Стехиометрические коэффициенты – это коэффициенты, определяющие количественные соотношения между реагирующими веществами.
Слева и справа от стрелок записаны все реагирующие вещества, исходные и конечные, так что  = 0 для конечных продуктов
= 0 для конечных продуктов  = 0 для исходных реагирующих веществ прямой реакции.
= 0 для исходных реагирующих веществ прямой реакции.
Скорость химической реакции. Пусть за время 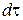 в ходе химической реакции число молекул каждого реагирующего вещества из общего их количества i =1, 2, …, k изменится на значение
в ходе химической реакции число молекул каждого реагирующего вещества из общего их количества i =1, 2, …, k изменится на значение  . При отсутствии обмена массы реагирующих веществ с окружающей средой
. При отсутствии обмена массы реагирующих веществ с окружающей средой
 , (56)
, (56)
т. е. изменение количеств реагирующих веществ пропорционально их стехиометрическим коэффициентам. Это одно из определений известного в химии закона кратных отношений. В ходе химических реакций происходит превращение одних веществ в другие, молекулы исходных веществ в процессе химического реагирования исчезают, однако количество каждого типа атомов сохраняется неизменным. Равенство (56) выражает сам факт сохранения атомов при химических превращениях. Иначе закон сохранения атомов можно записать в форме
|
|
|

 , (57)
, (57)
где Вji – число атомов j -го типа в i -м веществе; сi 0 – молярная концентрация вещества до реагирования. Изменение числа молей любого вещества в процессе реагирования называется скоростью реакций w =(dc i/ d  )/ ai, где
)/ ai, где 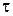 – время.
– время.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 689; Нарушение авторских прав?; Мы поможем в написании вашей работы!